

L'atome des chimistes
Si l'atomos idea - l'Idée
insécable - est l'invention magique des Abdéritains, l'"atome des
chimistes" - le nôtre aujourd'hui - est né dans la ville ionique de
Milet, en Anatolie occidentale. Là, en effet, au Vème siècle avant notre
ère, Thalès, Anaximandre et Anaximène fondent la théorie de la substance des
corps.
Tous trois admettent l'existence d'une substance primordiale, à la base de
tout. Cette "réalité primordiale", cet arché, c'est l'eau
pour Thalès, l'air pour Anaximène, une substance indéterminée (l'apéiron),
pour Anaximandre. Notons pour la suite de notre histoire que, au même moment,
sur son île natale de Samos, Pythagore offrit une autre solution : pour lui et
ses disciples, le principe fondamental, l'arché, c'est le nombre. Cette
conception suscitera des échos dans la théorie moderne de l'atome comme nous
le verrons un peu plus loin.
A Agrigente, au Vème siècle avant notre ètre, Empédocle formule sa théorie
des "quatre racines" (auxquelles il donne le nom des dieux : Zeux-eau,
Héra-Terre, Aidoneus-air et Nestis-feu). En se combinant en proportions
diverses, sous la férule de Polemos (la Haine) et d'Eros (l'Amour), ces racines
constituent tous les corps. Elles sont elles-mêmes constituées de petites
particules, insécables et éternelles comme les Idées de Démocrite, mais
séparées l'une de l'autre par des pores (et non par le vide). Elles ne sont
donc pas tout à fait les Idées de Démocrite.
Platon invente la chimie théorique
Platon a forgé une cosmogonie (dans Timée) originale que l'on
peut regarder comme la première tentative de formulation d'une "chimie
théorique" apte à rendre compte de la diversité des substances
présentes dans la nature. Incidemment, le mot "chimie" est
probablement d'origine égyptienne. La fameuse inscription de Rosette donne en
effet à l'Egypte le nom de chmi. La chimie serait la science de chmi ou de la
Terre noire - la science sainte, divine, secrète de l'Egypte... La cosmogonie
de Platon n'est pas celle de Démocrite et ne sera pas celle de d'Aristote,
élève de Platon, qui se démarquera de lui. Pour Platon, les Idées (qui ne
sont pas celles de Démocrite), les Nombres (qui sont ceux de Pythagore) et les
quatre éléments (qui sont deux d'Empédocle), qu'un démiurge, occupé à
façonner le monde (qu'il n'a pas créé, au passage), cherche à utiliser pour
en tirer "le meilleur des mondes".
A chacun des quatre éléments primordiaux, Platon fait correspondre un
polyèdre régulier : le tétraèdre (4 faces) pour le feu, le cube (6 faces)
pour la terre, l'octaèdre (8 faces) pour l'air et l'icosaèdre (20 faces) pour
l'eau. "Le Démiurge prit d'abord pour former l'Univers, du feu (des
tétraèdres) et de la terre (des cubes)." Puis, pour parachever son
oeuvre, il utilisa le cinquième polyèdre régulier, le dodécaèdre : "Le
Démiurge s'en est servi pour achever le destin de l'univers."
Platon a poussé très loin sa géométrisation de la constitution de l'univers.
Il note en effet que "toute surface de formation rectiligne est composée
de triangles" et que "tout triangle dérive de deux triangles, dont
chacun a un angle droit et les deux autres angles aigus". Il imagine donc
deux triangles à partir desquels les polyèdres réguliers peuvent être
construits. Bref, il trouve "sous l'atome les particules".
Cette étonnante théorie, brièvement esquissée ici, permet de faire des
"prédictions" : ainsi, la terre, dont les atomes sont des cubes
(constructibles à partir de triangles de type a),
se distingue des trois autres éléments dont les atomes sont faits de triangles
de type b.
Par ailleurs cette théorie rend la transmutation envisageable : un atome d'eau
à vingt faces peut, par exemple, se scinder en deux octaèdres d'air (à huit
faces chacun) plus un tétraèdre de feu (à quatre faces).
Naïve cette théorie ? Pas autant qu'elle en a l'air. En 1874, le français
Achille Le Bel (1847-1930) et le hollandais Jacobus Van't Hoff (1852-1911), qui
devait être le premier lauréat du prix Nobel de chimie (en 1901),
représenteront l'atome de carbone sous la forme... d'un tétraèdre régulier,
afin de schématiser l'aptitude de cet atome à se lier quatre atomes
monovalents, comme dans la molécule de méthane (CH4).
 |
 |
| Joseph-Achille Le Bel | Jacobus Henricus Van't Hoff |
Après son séjour à l'Académie de Platon, Aristote fonde sa propre école, le
Lycée, abandonne la théorie platonicienne des atomes à figure géométrique
et reprend la théorie d'Empédocle en lui apportant une importante modification
: il baptise "éléments" les racines d'Empédocle et introduit la
notion selon laquelle ces éléments s'opposent par des qualités fondamentales
contraires, les unes actives, les autres passives : le chaud, le froid, le sec
et l'humide. Ainsi, le feu est chaud et sec ; l'air, qui est une vapeur, est
chaud et humide ; l'eau est froide et humide ; la terre est froide et sèche.
Tout objet sur Terre - dans le monde "sublunaire" - est sujet au
changement : les corps se composent et se décomposent. Ce qui se trouve dans le
Ciel, par contraste, paraît demeurer éternellement identique à soi-même.
Autre différence entre Ciel et Terre : le mouvement naturel des corps est
rectiligne sur la Terre, circulaire dans le Ciel. Il apparaît ainsi que le
Ciel, comme tous les astres qu'il contient, est fait d'une substance différente
de celle présente dans le monde sublunaire - d'un cinquième élément, la
"quinte" essence, matière subtile, éternelle et incorruptible, que
saint Thomas d'Aquin, à la suite d'Aristote, appellera l'éther.
 |
| Platon (sous les traits de Léonard de Vinci) et Aristote, peints par Raphaël (L'Ecole d'Athènes). |
Gassendi : les atomes sont partout
!
Sautons les siècles. Né à Champtercier, près de Digne, en
Haute-Provence, Pierre Gassend, dit Gassendi (1592-1655), est, dès l'enfance,
marqué du sceau du génie. Jeune, il apprend par coeur six mille vers latins et
en récite chaque jour trois cents pour fortifier sa mémoire. Après la mort de
Richelieu, en 1642, il cède aux injonctions de ses supérieurs et gagne Paris
pour y enseigner les mathématiques au Collège Royal (le futur Collège de
France). Ami de Galilée, et contemporain de Descartes, il se donne pour mission
de remplacer la Physique d'Aristote, qu'il juge désuète, par une nouvelle
physique fondée sur une fusion de l'Idée abdéritaine avec le message
biblique. Il affirme que les atomes qui, pour Démocrite, sont non créés,
tiennent en réalité de Dieu leurs attributs.
 |
| Pierre Gassend, dit Gassendi |
Il postule avec enthousiasme l'existence d'atomes lumineux, d'atomes odorants,
d'atome sonores, d'atomes du chaud, d'atomes du froid... Leur forme détermine
leurs propriétés sensibles : pointus, ils constituent les choses piquantes ;
ronds, ils sont les choses fluides, etc. En un mot, les atomes sont partout,
"ils sont les vrais principes sur lesquels est bâti le monde".
Ce n'est pas tout. Dans la foulée, Gassendi rejette la doctrine des quatre
éléments d'Empédocle et des quatre qualités d'Aristote ; il postule, pour la
remplacer, la formation intermédiaire d'associations d'atomes : " A partir
des Atomes sont d'abord formées certaines molécules différentes entre elles,
qui sont les semences des choses différentes."
Molécules... Le mot est lancé. Enthousiasmés par cet enseignement, Ralph
Cudworth et Walter Charleton s'en font l'écho en Angleterre. Robert Boyle
(1627-1691), l'un des pères fondateurs de la Royal Society de Londres, leur
prête oreille ; il adopte l'atomisme de Gassendi et émet l'opinion que le
nombre de substances primordiales doit être plus grand que quatre. Il va
jusqu'à suggérer que les éléments proverbiaux sont en réalité des
substances composées. Composées, mais... de quoi ?
 |
 |
|
Sir Robert Boyle |
|
Secrètement, le plus grand alchimiste de son temps, Isaac Newton (1642-1727)
publie en 1704 son Traité d'Optique, que Jean-Paul Marat (l'ami du peuple en
personne !) traduit en français en 1787. Aux dernières pages de l'ouvrage,
Newton se livre à des spéculations concernant la nature de la composition des
corps : "Tous les corps semblent constitués de particules dures : sinon
les fluides ne gèleraient pas comme l'eau, les huiles, le vinaigre et l'esprit
de vitriol le font par le froid, le mercure par les fumées de plomb, l'esprit
de nitre et de mercure, en dissolvant le mercure et en évaporant le
Flegme."
Quant à la lumière : "Même les rais (qui la composent) semblent être des
corps durs ; car autrement ils ne conserveraient pas différentes propriétés
dans leurs différents côtés. Et par conséquent la dureté peut être
reconnue comme la propriété caractéristique de tous les corps
composés." Voilà le débat bien lancé. Restait à se mettre à faire de
la chimie, de la vraie chimie fondée sur l'expérimentation, l'observation et
la mesure.

La voie royale de la chimie
Avant de périr sous le couperet de la guillotine, Antoine Lavoisier
(1743-1794) prouve que l'air est un mélange de deux gaz qu'il baptise
"oxygène" et "azote", et démontre la structure composée
de l'eau. Ni l'air ni l'eau ne sont des éléments ! La théorie des quatre
racines d'Empédocle s'effondre. Lavoisier déclare : "Toute substance que
nous n'avons pas encore pu décomposer par aucun moyen est pour nous un
élément." Il en définit trente-trois, dont la lumière (pourquoi pas ?).
 |
| Jérémias Richter |
En 1792, Jeremias Richter publie sa Stoichiometry. Dans beaucoup de réactions chimiques, note-t-il, on voit un composé AB, constitué de deux parties A et B, se combiner en un composé A'B', également constitué des parties A' et B', selon l'équation
AB + A'B' = AB' + A'B
Il en conclut que les quantités A
et A' d'une part, B et B' d'autre part, étant interchangeables, sont donc des
"équivalents".
Instituteur dans une école quaker à Manchester, John Dalton (1766-1844)
fréquente à ses moments perdus un aveugle, John Gough, philosophe de la
nature, qui lui enseigne le latin, le grec, le français, les mathématiques,
l'astronomie et surtout... l'art de l'observation (Dalton lui-même voyait mais
souffrait de... daltonisme !).
Dalton s'intéresse d'abord à la météorologie, puis aux mélanges gazeux,
dans le but d'étudier l'absorption de l'eau par l'air. Il acquiert la
conviction que les gaz sont des fluides élastiques constitués de petits
corpuscules, ou atomes, qui s'attirent et se repoussent selon des lois de type
newtonien, et arrive à la conclusion qu'il faut différencier les atomes de gaz
par leurs poids. S'inspirant des travaux de Richter sur les
"équivalents" dont nous venons de parler, et de ceux de Joseph Proust
(1754-1826) qui les prolongent (1802), il construit une table du poids relatif
des éléments (par rapport au poids de l'atome d'hydrogène, qu'il considère
arbitrairement comme égal à 1) fondée sur trois hypothèses révolutionnaires
: les atomes sont les constituants ultimes indivisibles et indestructibles de la
matière ; les atomes d'un élément sont tous identiques ; les molécules des
corps composés sont formés d'un assemblage d'un nombre défini d'atomes de
leurs constituants.
1808. Dalton publie l'ensemble de ses découvertes dans son New System of
Chemical Philosophy. Il y représente ses atomes par de petits cercles
agrémentés de signes distinctifs.
 |
 |
 |
|
Ces symboles, qui évoquent ceux utilisés par les alchimistes, ont été remplacés depuis par ceux, plus commodes et que nous utilisons encore aujourd'hui, proposés par le suédois Jöns Jacob Berzélius (1779-1848) : H pour l'hydrogène, C pour le carbone, O pour l'oxygène...
|
|
|
Jöns Jacob Berzélius |
Dalton n'emploie nulle part dans ses explications le mot "molécule".
Pour lui, tout est "atome" : il parle de l'atome d'eau, de l'atome
d'ammoniac, etc... A propos du gaz carbonique par exemple, il justifie ainsi sa
terminologie : "Maintenant, bien que cet atome puisse être divisé, il
cesse alors d'être l'acide carbonique, étant décomposé en carbone et en
oxygène. Je ne vois donc aucune incohérence à parler des atomes
composés."
Aucune incohérence, certes, mais de la confusion que le mot
"molécule" utilisé aujourd'hui évite. Les diagrammes par lesquels
Dalton représente les molécules sont fondés sur sa conception de "poids
équivalents". Il écrit HO pour l'eau, HN pour l'ammoniac, etc... Dalton
se trompe dans les détails, mais, comme saint Jean Baptiste, il a ouvert la
voie. D'autres allaient en tracer la suite. L'un d'eux, et non des moindres, fut
Louis Gay-Lussac.
Gay-Lussac et Avogadro
Prolongeant les travaux de Lavoisier et de Dalton, Louis Gay-Lussac (1778-1850)
établit avec précision en 1805 la composition d'un certain nombre de
substances gazeuses. Il annonce que les éléments entrent dans la composition
de ces substance dans des proportions ayant toujours entre elles des rapports
simples.
 |
 |
| Louis-Joseph Gay-Lussac | Jean-Baptiste Dumas |
Professeur de chimie à l'Ecole
Polytechnique un demi-siècle plus tard, Jean-Baptiste Dumas (1800-1884) raconte
ce qu'il advint ensuite : "Lorsque Gay-Lussac fit connaître sa belle loi
sur les combinaisons de gaz [...], on devait s'attendre à la trouver adoptée
et développée [par Dalton] car c'était une bonne fortune rare pour un
inventeur. Eh bien ! pas du tout ! Dalton la repousse avec une sorte de
dédain... "Si, dit-il, cette loi est vraie, c'est une traduction de la
mienne. Vous nommez volume ce que j'appelle atome : voilà la seule
différence.""
Les découvertes de Gay-Lussac cachaient cependant une difficulté qui allaient
diviser les chimistes pendant de longues années. "Les observations de
Gay-Lussac, nous dit Dumas, [suggéraient] que les gaz renferment le même
nombre d'atomes à volume égal. Il faut pourtant s'expliquer : car un volume de
chlore et un volume d'hydrogène en font deux d'acide chlorhydrique... Par
conséquent, il faut que l'atome de chlore et celui de l'hydrogène puissent se
couper en deux, pour donner naissance aux deux atomes de gaz
chlorhydrique."
L'italien Amedeo di Quaregna e Ceretto Avogadro (1776-1856), résout l'énigme
en 1811 : la molécule d'hydrogène, explique-t-il, comme celle du chlore
gazeux, est un assemblage de deux atomes. Lorsqu'on combine chlore et hydrogène
gazeux, on a donc H2 + Cl2 = 2 HCl, et non H + Cl = HCl. Et voilà pourquoi deux
volumes d'acide chlorhydrique sont produits dans cette réaction. Notons que
pour Avogadro, à l'encontre de Dalton, tout est une "molécule" - que
celle-ci soit "intégrante" (pour nous un atome) ou
"composée" (pour nous une molécule).

Chimistes en congrès
Le 3 septembre 1860, cent quarante chimistes éminents venus des quatre
coins de l'Europe se réunissent en congrès à Karlsruhe - c'est le premier
congrès international de l'histoire de la science. Leur objectif : tenter de
concilier les points de vue divergents concernant l'atome (et les molécules !)
qui opposent les chimistes entre eux. A la seconde séance plénière, le 4
septembre, le jeune chimiste August Kekule von Stradonitz (1829-1896), promoteur
du congrès, met les choses au point : "Dans les réactions chimiques il
existe une quantité qui y entre ou qui en sort en plus petite proportion et
jamais dans une fraction de cette proportion. Ces quantités [...] sont les
molécules définies chimiquement. Mais ces quantités ne sont pas indivisibles,
les réactions chimiques parviennent à les couper et à les résoudre en
particules absolument indivisibles. Ces particules sont les atomes. Ainsi la
molécule de chlore est formée de deux atomes."

Avec cet exposé lucide (et prophétique), on pourrait croire le débat
terminé. Il va pourtant durer encore plusieurs années. Le problème qui
demeure est celui d'accepter ou non les deux hypothèses d'Avogadro selon
lesquelles la molécule de nombreux gaz serait faite de deux atomes et le nombre
des molécules dans un gaz serait toujours le même, à volume égal.
Charles Gerhardt (1816-1856) tire des hypothèses d'Avogadro une conséquence
qu'il formule dans son Précis de chimie organique en 1853 : il est
possible de représenter la molécule de chaque substance par une formule qui
exprime clairement "combien d'atomes de chaque sorte sont contenus dans la
molécule". La formule H2O par exemple indique que la molécule
d'eau contient deux atomes d'hydrogène et un atome d'oxygène - sans suggérer
toutefois, notons-le, l'arrangement géométrique particulier des atomes entre
eux.

Structure moléculaire et valence
En 1853, le chimiste anglais Edward Frankland (1825-1899) s'aperçoit
que certaines combinaisons d'atomes, les radicaux (mot forgé par Louis Guyton
de Morveau, collaborateur et ami de Lavoisier), forment avec les métaux des
composés dont les propriétés rappellent singulièrement celles de certains
composés plus courants. Dans son livre Les Atomes, publié en 1913 et devenu un
classique, Jean Perrin (1871-1942), futur prix Nobel (1926) et futur fondateur
du Palais de la Découverte (en 1937), explique : "Quand nous disons que le
méthane CH4 et le chlorure de méthyle CH3Cl ont la même
structure moléculaire, nous supposons que le "radical" CH3
n'a pas été modifié par la chloruration et qu'il est lié à l'atome Cl (dans
la molécule CH3Cl) comme il l'était à l'atome H (dans la molécule
CH4). On dira que le groupement CH3 du chlorure de
méthyle existe dans la molécule d'alcool méthylique qu'on écrira donc CH3OH
(plutôt que CH4O)."

Cette importante avancée ne résout pas tous les problèmes, cependant :
"Nous n'avons rien supposé encore, en effet, sur les forces qui
maintiennent assemblés les atomes d'une molécule. Il se pourrait que chaque
atome de cette molécule fût lié à chacun des autres par une attraction
variable suivant leur nature et décroissant rapidement avec la distance."
Mais Jean Perrin montre que cette hypothèse est intenable. "Si l'atome
d'hydrogène est attiré par l'atome d'hydrogène, pourquoi, demande-t-il, la
seule molécule construite avec des atomes d'hydrogène serait-elle H2, en sorte
que la capacité de combinaison de l'hydrogène avec lui-même est épuisée
dès que deux atomes se trouvent unis ?" Il en conclut que "tout se
passe [...] comme si de chaque atome d'hydrogène sortait une main, et une seule
(et que) dès que cette main saisit une autre main, la capacité de combinaison
de l'atome est épuisée". La notion de valence résulte directement de
cette analyse. Elle consiste à admettre que dans une molécule "les atomes
sont assemblés par des sortes de crochets ou de mains, chaque liaison unissant
deux atomes seulement".
Ce type de raisonnement, dont on admirera la subtilité, a permis aux chimistes
d'élucider la formule de constitution des molécules. Jean Perrin nous donne
l'exemple de l'acide acétique, dont la molécule est à la fois simple (elle
contient seulement huit atomes) et compliquée : sa formule de constitution
"rappelle immédiatement les rôles différents des atomes d'hydrogène
(trois remplaçables par du chlore, et le quatrième par un métal), des atomes
d'oxygène (le groupement OH étant remplacé dans la formation du
chlorure d'acide CH3COCl), et des atomes de carbone eux-mêmes
(l'action d'une base KOH sur un acétate CH3CO2K partage
la molécule en méthane et carbonate)".
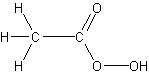
Bref, la formule de constitution nous
fournit beaucoup plus d'informations que la simple "formule
moléculaire" ; en nous permettant de visualiser le rôle que les atomes
qui la composent sont aptes à jouer dans les réactions chimiques, elle a
"un pouvoir de représentation immense en ce qui regarde les réactions
possibles du composé".
Avec cette remarque, la représentation des molécules prend sa forme
définitive. Encore fallait-il préciser la notion de valence : "Si tous
les atomes étaient monovalents (comme l'atome d'hydrogène), une molécule ne
pourrait jamais contenir que deux atomes : il y a donc des atomes
polyvalents." Assurément ! Et l'un d'eux est l'atome de carbone.
Dans un grand nombre de ses composés, l'atome de carbone est lié chimiquement
à quatre atomes, c'est-à-dire tétravalent. Pour refléter ce fait, Le Bel le
représente par un tétraèdre (la particule du feu de Platon !) aux quatre
pointes duquel peuvent s'attacher d'autres atomes. L'idée n'est pas aussi
farfelue qu'elle en a l'air : Linus Pauling, deux fois prix Nobel (en 1954 et en
1962), la reprend et l'améliore en 1963. Il montre comment attacher deux
tétraèdres l'un à l'autres pour former des molécules dans lesquelles deux
atomes de carbone sont liés l'un à l'autre par des liaisons simples, doubles
ou triples.
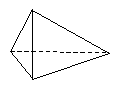 |
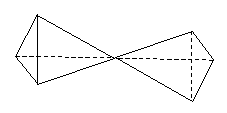 |
 |
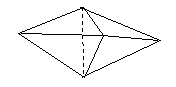 |
Nous représentons aujourd'hui ces trois
types de liaison de façon plus simple au moyen des symboles.
Comme chacun sait, l'atome de carbone entre dans la composition d'un nombre
incalculable de molécules, dont certaines jouent un rôle déterminant dans les
fonction de la vie. Quelques-unes contiennent des "anneaux" dont
certains sont parfois "contre nature". Il en est ainsi dans la
molécule de "cubane", de formule C8H8, dans
laquelle huit atomes de carbone forment un cube. Cette molécule constitue un
puissant explosif tant elle a de mal à soutenir le stress angulaire anormal
(des angles de 90°) imposé aux atomes qui la composent.
De l'électricité... dans l'atome
Fondamentale fut la construction, en 1887, à l'âge de vingt-cinq ans, du
suédois Svante Arrhenius (1859-1927), futur directeur de l'Institut Nobel de
Stockholm, prix Nobel de chimie en 1903. Il se demande : lorsqu'on dissout un
peu de sel dans de l'eau, qu'advient-il aux atomes de sodium (Na) et de chlore
(Cl) qui entrent dans la composition de ce sel ? Tout se passe, observe
Arrhenius, comme si - au moins quand la solution est très diluée - les
molécules NaCl se brisaient en atomes Na et Cl et qu' "une solution
diluée de sel marin ne renfermait réellement plus de sel, mais seulement du
sodium et du chlore à l'état d'atomes libres".

Atomes libres... Pas tout à fait. L'eau
salée conduit le courant électrique. Pour rendre compte de ce fait, Arrhenius
suppose que les atomes libérés lors de la dissolution du sel sont, non pas des
atomes, mais des ions chargés électriquement, l'un positivement (celui de
sodium), l'autre négativement (celui de chlore).
La théorie des ions d'Arrhenius est devenue partie intégrante de la chimie
avec la découverte que tous les atomes ou groupes monovalents d'atomes portent,
quand ils deviennent libres sous forme d'ions, la même charge élémentaire e,
positive ou négative. En s'appuyant sur des arguments de nature purement
chimique, Arrhenius venait d'établir la présence dans l'atome d' "unités
élémentaires d'électricité", d' "atomes d'électricité",
découverte que les physiciens allaient bientôt confirmer.