L'origine des éléments chimiques
Les atomes ne sont pas là depuis toute éternité.
Certains ont été créés lors du Big Bang, d'autres dans les étoiles et
quelques-uns par chocs dans le milieu interstellaire. Depuis moins d'un siècle,
l'homme commence à en fabriquer à son tour.
Un atome est un assemblage de protons (de charge électrique positive) et de
neutrons (électriquement neutres), le tout entouré d'électrons (de charge
négative). Tous les atomes qui possèdent le même nombre de protons (ou
d'électrons) se comportent comme un même "élément chimique", car
c'est le nombre d'électrons d'un atome qui détermine ses propriétés
chimiques. Certains éléments, comme le fer, le cuivre, l'étain, l'argent,
l'or, le mercure et le plomb, sont connus depuis l'Antiquité. A l'instar
d'Aristote, les philosophes de l'époque pensaient que chaque constituant de la
matière était un assemblage de quatre "éléments" fondamentaux,
l'air, l'eau, la terre et le feu, eux-mêmes existant sous différentes
conditions de température et d'humidité (les "qualités").

Au XVIIIème siècle, les chimistes avaient reconnu 33
éléments sur les 92 que l'on détecte dans la nature. Ce n'est qu'au siècle
suivant qu'on commença à les classer suivant leurs propriétés chimiques. En
1817, Johann Döbereiner pointa des groupes de trois (triades), tels le lithium,
le sodium et le potassium ou le chlore, le brome et l'iode. Mais ce sont le
polonais Julius Lothar Myer et le russe Dimitri Ivanovitch Mendeleiev qui,
séparément, entre 1868 et 1969, présentèrent un tableau de classement des
éléments connus. Laissant des cases disponibles pour les découvertes futures,
Mendeleiev modifia l'évaluation des masses des 26 éléments afin qu'ils
s'insèrent bien dans son classement. Les trois cases qu'il laissa vide furent
comblées par le gallium (1875), le germanium (1886) et plus tard par le
technétium (1937, qui n'existe pas sur Terre. Toute une classe d'éléments
inertes chimiquement, les gaz rares, fut découverte par William Ramsay et John
Rayleigh entre 1894 et 1898, et alors incorporée dans le tableau.
Le nom des éléments était originellement donné par leur découvreur. Pour
les premiers, l'idée était d'identifier les éléments suivant leur origine ou
leur particularité. Ainsi, l'hydrogène est à la base de l'eau (hydro), alors
que l'azote, nommé par Lavoisier, signifie en grec "sans vie". Des
considérations patriotiques intervinrent parfois : ainsi, le français Lecoq de
Boisbaudran baptisa le gallium tandis que l'allemand Winkler nommait le
germanium et Marie Curie le polonium, du nom de sa patrie d'origine. Depuis la
seconde moitié du XXème siècle, la course effrénée entre différents
laboratoires pour découvrir des éléments très lourds a donné lieu à de
nombreuses disputes pour identifier le découvreur. Depuis 1997, c'est l'Union
Internationale de Chimie Pure et Appliquée (UICPA ou UIPAC) qui tranche. Le
plus souvent, les nouveaux noms rendent hommage aux grands physiciens :
einsteinium, fermium, seaborgium ... ou aux laboratoires : berkélium, dubnium
... Ainsi, le 1er novembre 2004, l'élément 111 a été officiellement nommé
roentgenium (Rg) en l'honneur de Wilhelm Conrad Roentgen, découvreur des rayons
X en 1895.
Avant les années 1930, les physiciens penchaient encore pour un Univers stable
et éternel. Les éléments devaient donc être là depuis toujours, même si,
à la fin du XIXème siècle, cette idée préconçue avait été lézardée par
la découverte de la désintégration spontanée de certains éléments.
L'observation de l'expansion de l'Univers, et l'élaboration de la théorie du
Big Bang allaient tout remettre en question. Si l'Univers était né un jour,
les éléments avaient donc été fabriqués quelque part. En 1948, l'américain
George Gamow (un des pères du Big Bang) voyait dans cette naissance de
l'Univers le chaudron nucléaire universel. Tous les éléments devaient y être
apparus. Mais alors, toutes les étoiles devraient avoir la même composition,
ce qui n'est manifestement pas le cas. Les plus vieilles étoiles de notre
Galaxie contiennent dix à mille fois moins d'éléments lourds que le Soleil.
Les calculs de nucléosynthèse primordiale (la synthèse des noyaux atomiques
lors du Big Bang) ne corroborent pas non plus cette hypothèse. L'Univers, avant
sa première seconde, a créé les protons et les neutrons à partir d'une soupe
de quarks et de gluons. Quelques noyaux d'hydrogène ont fusionné pour former
du deutérium (un proton et un neutron), puis de l'hélium et du lithium ; mais
l'Univers s'est si rapidement refroidi qu'aucun autre élément n'a pu se
former. En effet, en moins de 100 secondes, il baignait dans un bain de moins
d'un million de degrés : une température trop basse pour que des réactions de
fusion nucléaire puissent se dérouler. Mais cela a suffi pour former un océan
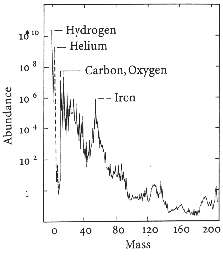
de matière constitué d'environ 76 % d'hydrogène, 24 % d'hélium 4 (4
désignant le nombre de nucléons du noyau), et un peut de deutérium, d'hélium
3 et de lithium 7. La chaîne s'est arrêtée là, car la fusion d'un proton et
d'un noyau d'hélium comme celle de deux noyaux d'hélium 4 ne produit pas de
noyau stable. Cette proportion est peu ou prou celle que l'on retrouve
aujourd'hui dans notre environnement galactique, car on y rencontre environ 72 %
d'hydrogène, 26 % d'hélium et 2 % d'éléments plus lourds.
Les étoiles participent donc à la fabrication des
éléments : c'est ce que montra Hans Bethe en 1939, puis, de manière plus
précise, le B²FH (les américains Margaret Burbidge, Geoffrey Burbidge,
William Fowler et le britannique Fred Hoyle) en 1957, les 4 coauteurs de cette
publication qui fit date et se révéla juste au vu des observations suivantes.
Si l'hélium s'est formé durant les premières phases de l'Univers, il s'en
crée aussi dans les coeurs stellaires selon le même mécanisme, c'est-à-dire
par fusion de l'hydrogène. Cela commence quand l'étoile naissante, qui est en
train de se contracter sous l'effet de sa propre masse, atteint en son coeur 10
millions de degrés. Quatre protons, dont deux vont se transformer en neutrons
par désintégration b+
(avec émission d'un antiélectron, le positon, et d'un neutrino), fusionnent
successivement pour donner un noyau d'hélium. La masse d'un noyau d'hélium
étant inférieure à celle de quatre protons, le surplus est converti en
énergie dont la pression contrebalance la contraction de l'étoile :
celle-ci se stabilise. Pour le Soleil, cette phase dure 10 milliards d'années,
et persistera donc encore pendant environ 5 milliards d'années. Il grossira
ensuite pour devenir une étoile géante rouge. En même temps, son coeur se
contractera et s'échauffera jusqu'à 100 millions de degrés, permettant à
l'hélium de fusionner à son tour en carbone, azote et oxygène.
Le mécanisme de fusion de l'hydrogène est différent selon que l'étoile a une
masse inférieure ou supérieure à une fois et demie celle du Soleil. Dans les
moins massives, c'est le cycle proton-proton (cycle pp) qui gouverne la fusion
de l'hydrogène. Deux protons s'allient pour former du deutérium (un proton
devient un neutron en émettant un positon et un neutrino). Puis ce noyau de
deutérium capte un autre proton pour former de l'hélium-3 (deux protons, un
neutron). Enfin, deux noyaux d'hélium-3 s'allient pour créer un noyau
d'hélium-4 (deux protons, deux neutrons) en libérant deux protons.
Le processus est différent en ce qui concerne les étoiles dont la masse
dépasse une fois et demie celle du Soleil et qui contiennent déjà quelques
éléments plus lourds que l'hélium. Ce sont alors le carbone, l'azote et
l'oxygène, formés auparavant au sein d'autres étoiles et incorporés au
milieu interstellaire à partir duquel l'étoile s'est formée, qui vont servir
de catalyseurs en capturant tour à tour un proton. Le carbone-12 devient alors
azote-13 qui se décompose en carbone-13 lorsqu'un proton se désintègre en un
neutron. Le carbone-13 capte lui aussi un proton et devient azote-14, qui se
décompose, et ainsi de suite jusqu'à l'oxygène-16 qui fissionne en un noyau
de carbone-12... et un noyau d'hélium-4.
Autre différence entre les étoiles, seules celles de plus de 10 masses
solaires peuvent fabriquer les éléments plus lourds que l'oxygène, car elles
seules peuvent se contracter suffisamment pour que leur coeur atteigne la
température de 600 millions de degrés. C'est la température nécessaire pour
que du carbone naisse le néon-20. Comme la température augmente aussi
autour du coeur, des couches plus superficielles vont être à leur tour le
siège de la fusion nucléaire. Au fur et à mesure que le coeur se contracte,
l'étoile ressemble à un oignon dont les pelures sont les lieux de fusion des
divers groupes d'éléments.
A 1,5 milliards de degrés, le néon se casse en oxygène en libérant un noyau
d'hélium-4. Quand celui-ci vient heurter un noyau de néon restant, il se forme
du magnésium-24. A 2 milliards de degrés, l'oxygène fusionne. Se forment
alors du silicium-28 et du soufre-32. Les autres éléments se forment dans un
milieu très chaud et donc très violent. S'installe alors un équilibre entre
les fusions et les photodésintégrations. Les noyaux dont les nucléons sont
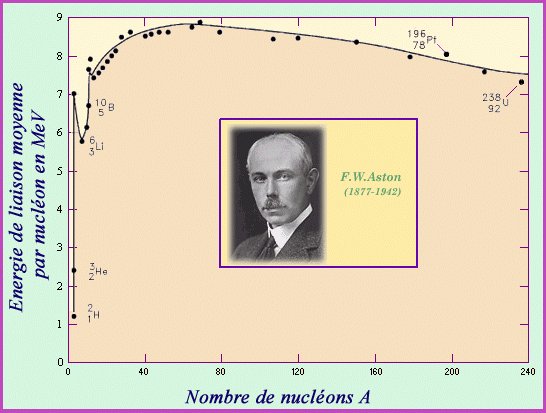
les plus liés en sortiront vainqueurs. Le roi en la matière est le fer (26
protons, 30 neutrons). Au-delà de cet élément, les réactions de fusion
consomment de l'énergie et n'empêchent plus l'étoile de se contracter.
Alors, son coeur, dilapidant sont énergie à briser les noyaux de fer et privé
du soutien des électrons (absorbés par les protons), s'effondre. Puis,
atteignant une densité supérieure à celle des noyaux d'atome, il se détend,
communiquant aux couches qui l'entourent un mouvement divergent. L'étoile
explose en supernova en une fraction de seconde. L'onde de choc qui se propage
vers l'extérieur permet de fabriquer du nickel-56 (28 protons, 28 neutrons),
élément instable qui se décompose en fer via le cobalt. Ce phénomène est
accrédité par l'observation des courbes de lumière des supernovae dont le
déclin s'effectue au rythme de la désintégration du cobalt-56 (soit 80 jours
environ).
Dans la production des éléments plus lourds que le fer, la fusion ne joue plus
aucun rôle, car elle demande des températures que les étoiles, même les plus
massives, ne peuvent atteindre avant de devenir explosives. Mais avant qu'elles
terminent en supernovae, ces étoiles massives sont des supergéantes rouges,
dans l'atmosphère desquelles la production d'éléments lourds tels le
carbone-13 et le néon-22, dégage une quantité non négligeable de neutrons.
C'est leur capture, facilitée par le fait qu'ils ne sont pas repoussés par la
force électrostatique, qui nous fait avancer sur le chemin de la complexité
nucléaire. Deux processus semblent à l'oeuvre. Dans les deux cas, les noyaux
qui capturent des neutrons sont instables : un ou plusieurs neutrons vont se
transformer en protons par radioactivité b-
(avec émission d'un électron et d'un neutrino), créant un élément de nombre
atomique plus élevé.
Le processus "s", comme slow, est, comme son nom l'indique, un
mécanisme qui demande du temps, au moins celui qui permet la désintégration b-.
Il fonctionne au sein des étoiles géantes rouges et semble responsable de la
création des éléments jusqu'au bismuth (83 protons) bien que les détails de
cette chaîne ne soient pas encore entièrement connus. Au-delà, ce processus
s'arrête car les 84 protons du polonium (découvert par Marie Curie dans la
désintégration du radium) se désintègrent par émission d'un noyau d'hélium
(radioactivité a). Le
polonium redevient du plomb (82 protons).
C'est dans les phases explosives des supernovae que la capture des neutrons,
dite "r" comme rapide, va prendre le relais. Pendant cette phase très
courte - quelques secondes - qui se situerait dans la bulle très chaude
entourant l'étoile à neutrons en formation, le flux de neutrons est tellement
intense (1036 par cm²) que 10 à 20 neutrons vont s'intégrer en
même temps dans les noyaux existants. Quand ce sont des noyaux de plomb ou de
bismuth, la cascade de désintégrations qui s'ensuit produit tous les noyaux
lourds jusqu'au thorium ou l'uranium. C'est aussi comme cela que les étoiles
fabriquent de l'or et du platine.
Il se fabrique également des éléments dans l'espace interstellaire, par un
mécanisme appelé spallation, sorte de fission nucléaire due à l'impact de
protons et autres noyaux cosmiques. Cette idée fut avancée en 1970 par le
groupe de René Bernas et Hubert Reeves à l'Université d'Orsay, puis par Jean
Audouze, Elisabeth Vangioni-Flam et Michel Cassé à l'Institut d'Astrophysique
de Paris. Elle se révéla très féconde pour expliquer la formation de
certains noyaux légers très instables dans des conditions de température
élevée, comme le lithium-6, le béryllium-8 et les bore-10 et 11. Ils sont
issus de quelques fissions dues aux chocs que subissent des noyaux de carbone,
d'azote ou d'oxygène dans l'espace interstellaire lors d'explosions d'étoiles
ou sous l'effet de forts vents stellaires. Ce mécanisme rare explique leur
très faible abondance : pour 100 milliards de noyaux d'hydrogène, il y a
environ 100 noyaux de lithium, 10 noyaux de bore et 1 seul noyau de béryllium.
Fred Hoyle, grand pourfendeur de la théorie du Big Bang et donc de la création
des éléments au début de l'Univers, pensait à tort que ces éléments
étaient créés dans les étoiles. Mais leurs nucléons sont très peu liés et
ne résistent pas à la fusion thermonucléaire : ils ne peuvent donc pas s'y
former. Et comme le deutérium, ils sont très vite brûlés dans les chaudrons
stellaires.
Les éléments ne sont pas tous stables, loin de là. La question serait même
plutôt de savoir s'il en existe une seul qui soit stable... Si, comme le
recherchent depuis trente ans les astrophysiciens, on observait la
désintégration d'un proton, la réponse serait évidente : non. On imagine que
sa durée de vie dépasse les 1031 ans. Un neutron libre, lui, ne
résiste au maximum que 20 minutes. Les noyaux légers sont stables quand leurs
quantités de protons et de neutrons sont égales. Au-delà du calcium (20
protons), il faut davantage de neutrons (environ 1,5 neutron par proton), un
surplus qui compense la répulsion électrostatique entre les protons.
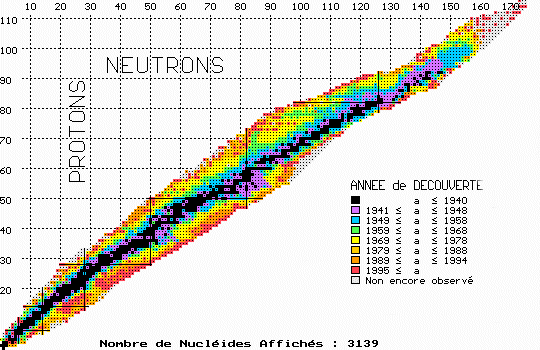
L'étude des différents noyaux montre qu'ils sont plus stables si leur nombre de nucléons est pair. Encore plus s'il est multipke de quatre. Mais plus l'élément étudié est proche du fer ou le dépasse, moins il est stable. Ils sont même tous instables au-delà du plomb (82 protons), même si la durée de vie de certains se chiffre en milliards d'années. Celle du bismuth est même de 1,9.1019 ans ! Mais si un éléments chimique rassemble des atomes identiques, il inclut aussi ceux qui ne diffèrent que par leur nombre de neutrons, puisqu'ils ont les mêmes propriétés chimiques. On les appelle alors isotopes ("même place", dans le tableau périodique). Ainsi, le noyau d'hydrogène, l'élément le plus léger, n'est constitué que d'un proton. Mais les noyaux de ses deux isotopes, le deutérium et le tritium, contiennent en plus, respectivement, un et deux neutrons. Chaque élément possède un isotope plus stable que les autres. S'il existe environ 130 éléments chimiques, il existerait environ 10 000 de leurs isotopes dont la durée de vie (durée au bout de laquelle la moitié des noyaux se désintègrent) est supérieure à 10-21 seconde. Il n'y a cependant aucun accord sur ces chiffres.
Les alchimistes rêvaient de fabriquer des éléments. Ainsi, la capture de
neutrons sur de l'uranium, une idée d'Enrico Fermi, permit de créer de
nombreux "transuraniens". Le neptunium (93 protons), découvert en
1940 par Mc Millan, fut le premier de la série. L'année suivante, Glenn
Seaborg découvrait le plutonium, bien que celui-ci fut retrouvé ensuite sur
Terre, dans les mines d'uranium d'Oklo, au Gabon, où avait débuté, il y a 2
milliards d'années, une réaction de fission nucléaire naturelle.
Les physiciens du XXème siècle ont aussi trouvé de nouveaux éléments sans
le vouloir. Les travaux effectués sur les bombes atomiques dans les années
1940 ont permis de réaliser des expériences que la nature ne permet pas, faute
de pouvoir rassembler assez d'une matière spécifique. L'einsteinium (99
protons) et le fermium (100 protons) furent découverts dans les cendres de
l'essai nucléaire américain Mike en 1952. Entre 1945 et 1961, neuf nouveaux
éléments furent ainsi ajoutés à la liste.
A cause de la répulsion électrique des protons, plus les noyaux sont gros et
plus ils sont instables. Il faut donc laisser aux noyaux cibles le temps d'être
frappés par un nombre considérable de noyaux avant d'atteindre la bonne
configuration. Régulièrement, les allemands de GSI, les américains du
Lawrence Berkeley National Laboratory (LBNL) ou les russes de Dubna annoncent la
synthèse d'un nouvel élément, aussitôt mis en doute par leurs concurrents.
Or, ces découvertes ne sont validées que si un autre laboratoire reproduit ces
observations. Ce n'est pas toujours le cas : en 1999, le LBNL croyait avoir
synthétisé l'élément 118 et son produit de désintégration, l'élément
116. Il s'est rétracté deux ans plus tard.
Dernière annonce en date : l'Institut de Recherche Nucléaire de Dubna a
annoncé, en 2004, avoir produit quatre noyaux de l'élément 115. Ces quatre
noyaux se seraient décomposés en approximativement 90 millisecondes en
élément 113, lui aussi alors inconnu, par désintégration a
(émission d'un noyau d'hélium). Il y a aussi du nouveau du côté des noyaux
les plus petits : en 2002, un noyau sans proton aurait été découvert au Ganil,
en France. Il serait composé de quatre neutrons et vivrait assez longtemps pour
être détecté.
La probabilité de construire des noyaux stables décroît très vite avec le
nombre de nucléons qui les composent. La durée de vie des noyaux superlourds
déjà créés en laboratoire se chiffre en fractions de seconde. Il y a
cependant des exceptions. Certains éléments pourraient être plus stables que
leurs voisins. Ils se situeraient dans ce que les physiciens appellent des
"îlots de stabilité". Certains modèles prédisent, par exemple, que
l'élément 126 (avec 184 neutrons) ne se désintégrerait pas avant une
seconde. On aurait ainsi une chance de le détecter même si la probabilité de
le créer en faisant s'entrechoquer des ions lourds est très faible. En
théorie, le plus gros noyau serait une étoile à neutrons, puisqu'on peut
considérer ces étoiles hyperdenses de 10 kilomètres de rayon, restes
calcinés d'étoiles très massives, comme un seul gigantesque noyau composé
pour majorité de neutrons. Si l'on considère que ces étoiles mortes sont
approximativement constituées de 1 % de protons, elles formeraient un noyau de
masse atomique avoisinant 1061 et de numéro 1059 !