 |
Cliché de chambre à bulles |
Mauvaises surprises concernant le four micro-ondes
Le
phénomène est connu sous le nom de "sur-échauffement". Ça se
produit lorsque l'eau est chauffée et particulièrement lorsque le contenant
est neuf. En fait, l'eau se réchauffe plus rapidement que les bulles de vapeurs
peuvent se produire. Les bulles ne se formant pas ne dégagent pas la chaleur
accumulée, le liquide ne bout pas et se réchauffe au-delà de son point d'ébullition.
Ce qui se produit par la suite : l'eau est déplacée soudainement, ce qui
est un choc suffisant pour causer la création rapide de bulles qui expulsent
l'eau chaude.
Ce phénomène de retard au changement d'état a beaucoup fait parler. Il se
produit lorsque la substance persiste dans un état physique alors que les
conditions de température et de pression impliquent qu'il se trouve dans un
tout autre état physique : par exemple, de l'eau liquide à une température
inférieure à 0°C sous pression atmosphérique est en état de surfusion. Une
petite perturbation (appelée germe) suffit alors à provoquer le changement
d'état.
On raconte que durant le siège de Stalingrad, par une nuit glaciale de l'hiver
1942 (température extérieure -30°C), une troupe de chevaux affolés fuyant un
incendie se précipitèrent dans le lac Ladoga apparemment limpide et tranquille
pour échapper aux flammes ; ils moururent tous instantanément.
C'est l'agitation du lac en état de surfusion qui fut la cause de ce drame
(s'il a eu lieu !). Le lac tout entier se transforma brutalement en glace solide
et piégea les pauvres bêtes.
Hubert Reeves, dans L'heure de s'enivrer, écrit : "L'Univers, encore largement composé d'hydrogène en dessous du point de gel nucléaire, est l'analogie du lac Ladoga, toujours liquide, par cette froide nuit d'hiver 1942. Si la vague de froid était venue plus lentement, le lac aurait gelé et les chevaux auraient pu échapper à l'incendie et au tombeau de glace. Si l'expansion de l'Univers avait été plus lente, la matière cosmique se serait complètement transmutée en noyaux de fer. [...] L'Univers serait bien différent et l'humanité n'y serait jamais apparue. Ce qui a sauvé la vie aux chevaux russes nous l'a donnée..."
Une manipulation au laboratoire
Préparer une solution d'acétate de sodium à la concentration de 130 g pour
100 mL. Il se produira une cristallisation dendritique ultrarapide avec prise en
masse de la solution, lors de toute agitation ou introduction d'un corps
étranger.
D'autres applications
Les verres sont des liquides sous-refroidis figés pour lesquels la surfusion
est telle qu'il n'y a pas de propagation de la cristallisation à partir de
germes cristallins. Ce sont donc des solides amorphes dont la structure est
localement ordonnée mais globalement désordonnée. Un verre courant contient
principalement de la silice SiO2, du sodium Na et du calcium Ca.
Dans la galerie des glaces du palais de Versailles, certains miroirs anciens se
déforment "en goutte", comme s'ils commençaient à couler...
Avant que les physiciens aient mis au point des détecteurs ultraperfectionnés,
la détection des particules se faisait à travers les chambres à bulles. Une
chambre à bulles est une enceinte contenant de l'hydrogène liquide
surchauffé, à la limite de l'ébullition ; comme la chambre a été
soigneusement purgée de tout germe d'ébullition (poussières, bulles), ce
liquide ne bout pas, malgré une température supérieure à la température
d'ébullition (20,4 K). Lorsqu'une particule chargée se déplace dans un tel
milieu, elle forme un noyau d'ébullition et produit, sur son trajet, en cédant
localement de l'énergie, un chapelet de bulles, ce qui permet de visualiser sa
trajectoire.
 |
Cliché de chambre à bulles |
Le verglas, tant redouté les jours d'hiver, est un phénomène météorologique lié à la surfusion : il s'agit d'un dépôt de glace, généralement homogène et transparent, provenant de la congélation de gouttelettes de bruine ou de pluie, en surfusion, sur les objets dont la surface est à une température inférieure à 0°C, ou très légèrement supérieure.
Quand on refroidit de l'eau, depuis tout petit, on apprend qu'un glaçon se forme à 0°C. Du moins si l'on est à la pression atmosphérique normale, mais ça, on l'apprend un peu plus tard...
Par contre, il est possible d'avoir de l'eau liquide à des températures négatives, sans toucher à la pression. Curieux, mais pas si difficile que ça à visualiser. Voici une petite expérience que vous pouvez faire:
Achetez une bouteille d'eau déminéralisée (de l'eau distillée vendue pour les fers à repasser, elle est très pure, du moins, plus que celle du robinet...). Mettez-en quelques millilitres dans un tube à essais, un thermomètre planté dedans. L'ensemble est immergé dans un mélange de glace et de sel (qui peut descendre facilement à -10°C). Surveillez la température. Vous risquez fort, si vous ne touchez pas au thermomètre, de voir la température intérieure du tube chuter régulièrement, plus bas que 0°C. Si vous tentez alors de bouger le thermomètre, vous le sentirez se mouvoir librement (l'eau est encore liquide), puis se figer brutalement (l'eau prend en masse). Attention alors à ne pas le casser... La température sera remontée à 0°C, puis reprendra sa descente régulière. Bizarre non?
 |
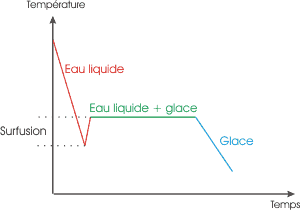 |
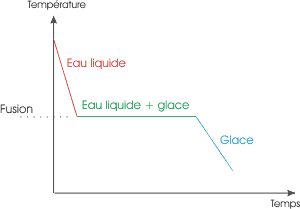
| Voilà ce qui se passe lors d'une solidification "classique" (ou fusion si on lit le graphique dans l'autre sens) . Lors de du passage liquide > solide, la température reste à 0°C tant que tout le liquide n'est pas solidifié. C'est un palier de température, qui a lieu lors du changement d'état. | Lors d'une surfusion, l'eau reste liquide en dessous de 0°C, mais, à la moindre perturbation, remonte à sa température classique de changement d'état. |
En fait, les impuretés contenues dans l'eau facilitent sa congélation. C'est un peu le même phénomène qui donne naissance aux bulles dans un verre de champagne, ou qui fait croître les flocons de neige. Des vibrations ou des secousses peuvent également favoriser la solidification. On comprend alors qu'un petit volume d'eau très pure soit favorable à une surfusion s'il n'y a aucune perturbation.
Le phénomène peut-être rendu encore plus marquant si l'on voit la congélation instantanée se produire. Ce n'est pas vraiment possible avec un tube à essais enfoncé dans un mélange réfrigérant. Mais ça le devient si vous vous enfermez dans le congélateur avec votre tube à portée d'oeil... Pas tenté? Essayez alors avec une webcam dans le frigo! regardez ce que cela donne.
 |
 |
 |
| Là, il fait encore "chaud", 3°C, l'eau est bien sûr liquide. | Surfusion! Il fait -5°C, l'eau est toujours liquide!... | Quelques secondes plus tard, l'eau s'est figée brutalement, la température est remontée à 0°C, puis est redescendue plus lentement, il fait -1°C ici... |
Vous pouvez voir le petit film correspondant (346 ko), ou l'on voit la congélation de l'eau se faire en masse...
A ce propos, il est une petite histoire, écrite par Malaparte ("Kaput"), que je vous résume rapidement: Dans les années 40, en hiver, une troupe de chevaux affolés par un incendie plonge dans les eaux de l'immense lac Ladoga, en Russie, près de la frontière Finnoise. Une fois entrés dans l'eau, celle-ci se congèle brutalement, emprisonnant les malheureux animaux... Cela ressemble bien à une solidification après une phase de surfusion. Mais il est quand même étonnant d'imaginer ce lac aussi pur et calme que ce qui est habituellement nécessaire de réunir comme conditions. Les chevaux ne se seraient-ils pas plutôt aventurés sur une glace trop fragile pour eux?...
| Un correspondant , Grégoire, m'a envoyé de Russie cet hiver un saisissant petit film: il fait -30°C dans un placard en équilibre avec la température extérieure. Dans ce placard, une bouteille d'eau minérale: liquide... Avec quelques chocs, elle fige à grande vitesse. Voyez ce film ici (1,16 Mo). |
 |
Ceci dit, on peut atteindre pas loin de -40°C avec de l'eau surfondue, dans d'excellents conditions! Quel sera votre record?
Retour aux questions de sciences