
Décomposer
la lumière ?
L’histoire de l’analyse de la lumière, c’est un
peu celle de toute l’astronomie ...
Parce que l’homme est doté de capteurs sensibles à la lumière, toute
variation d’intensité, tout éclat anormal attire son attention . De tous
temps, il a été subjugué par ces points lumineux qui luisent dans la nuit
sombre et dégagée . Quelle est leur nature ? Pourquoi, quel que soit le moyen
employé, ne peut-on atteindre ces cieux ? Comment lier cette vision à une réalité
maîtrisable et possible à appréhender ? Les avancées astronomiques se
confondent avec ces questions, et c’est avec la Renaissance et l’avènement
de la méthodologie scientifique que tout bascule .
En 1609, la lunette de Galilée amène par la même occasion les défauts
d’optique liés à la nature de la lumière ; en 1637, c’est Descartes qui
expose les lois de la réfraction et leurs applications dans la Dioptrique . En 1665, la diffraction est découverte par Grimaldi
puis l’année suivante c’est Roemer qui établit que la lumière a une
vitesse finie .

La lumière devrait par la suite être analysée de deux façons, par
deux théories : la nature corpusculaire avancée par Isaac Newton, et la nature
ondulatoire de Huygens, beaucoup plus tard . En 1672, Newton est le premier a
exposer la nature composite de la lumière blanche . Cette observation ouvre la
voie à de nouvelles formes d’analyse qui déboucheront notamment en 1864 sur
la théorie électromagnétique de Maxwell .
|
|
|
|
Si Newton supposait l’existence d’un rayonnement au-delà du visible,
du côté du rouge, c’est William Herschel qui, en 1789, le mettra en évidence
en déplaçant un thermomètre dans le rayonnement solaire décomposé par un
prisme (parce que Bradley avait inventé le thermomètre à mercure en 1729) .
En 1835, Ampère formulera le principe de l’origine vibratoire commune de la
lumière visible et invisible .

En 1801, Ritter avait déjà constaté l’action photochimique d’un
rayonnement, bientôt baptisé ultraviolet, sur les sels d’argent . Autant de
découvertes qui montrent qu’il y a de l’information au-delà de ce que nous
voyons . Et l’histoire ne s’est pas arrêtée là : infrarouge lointain,
ondes radar, ondes radio d’un côté, ultraviolet lointain, rayons X, rayon g, rayons cosmiques de l’autre balisent dorénavant
tous les domaines du rayonnement électromagnétique .

En étudiant plus finement la décomposition de la lumière solaire par
un prisme, Fraunhofer y découvre des milliers de raies, dont l’origine ne
sera expliquée qu’en 1859 par Gustav Kirchhoff . Un fabuleux terrain vient
d’être ouvert, et Huygens s’y rue en appliquant la spectroscopie aux étoiles
.
|
|
|
Dans le seul rayonnement visible, on pouvait obtenir pour des milliers
d’étoiles des spectres chargés de raies ; chaque raie étant la signature
d’un élément, il était possible de connaître la composition d’objets
lointains sans avoir à s’y rendre ... Et l’astronomie, trop longtemps
cantonnée aux seules mesures de positions ou de mouvements, laissait la place
à l’astrophysique . Aujourd’hui encore, la spectroscopie reste l’un des
outils les plus puissants de l’étude des étoiles : étendue en d’autres
longueurs d’ondes du domaine électromagnétique, elle permet de connaître la
composition des astres, leur vitesse radiale, leur température, leur distance .
En 1880, l’arrivée de la photographie, combinée à la spectroscopie, associées à des instruments toujours plus puissants permit un travail de catalogage sans précédent . Du Big Bang à l’évolution stellaire ou à la structure de l’Univers, tous les modèles actuels sont redevables aux pionniers de l’étude du rayonnement lumineux . Tant et si bien que l’astrophysique d’aujourd’hui se définit comme « les mille et une façons d’isoler l’information provenant des étoiles par la décomposition du rayonnement qui nous en arrive . »
Concrètement, à quoi ça sert ?
Pour décomposer la lumière, on utilise principalement deux dispositifs
de base : le prisme est le premier utilisé dans l’histoire, mais en
connaissant mieux la nature de la lumière, les réseaux (surfaces de verre gravées
de plusieurs milliers de traits par millimètre de support) sont tout aussi
efficaces .
La méthode consiste à encadrer le spectre enregistré par un spectre de
comparaison qui peut être le spectre d’une étoile déjà connu, un spectre
de lampe de laboratoire ... La comparaison est ensuite d’autant plus aisée
que l’opération est à présent numérisée et que des logiciels permettent
de calibrer et comparer les clichés . On peut alors utiliser le spectre obtenu
pour diverses interprétations :
- la nature des composants de l’objet étudié : lorsque la lumière
provenant d’un nuage de gaz léger , chaud et peu dense, est analysée, le
spectre comporte une série de raies brillantes . En revanche, lorsqu’un objet
émet de la lumière et que celle-ci traverse un nuage de matière, les photons
sont absorbés puis réémis dans n’importe quelle direction, atténuant
l’intensité dans certaines longueurs d’onde, ce qui se traduit par des
raies sombres sur le spectre . On peut donc connaître la composition d’une
concentration de matière ainsi que sa position relative à une source
excitatrice .
- la vitesse par rapport à l’observateur : le décalage des raies par
rapport à celles obtenues en laboratoire peut se faire soit vers le bleu, soit
vers le rouge . C’est Christian Doppler qui en fournit en 1842 la première
interprétation, qui porte son nom : le décalage correspond à la formule
D
= 1 + N , avec N vitesse
radiale (approche ou éloignement) par rapport à l’observateur ; lorsque la
source s’approche, on définit par convention N négative . Une analyse plus
fine en astrophysique permet de distinguer l’effet Doppler relativiste, le décalage
vers le rouge dû à la gravitation, et le décalage vers le rouge cosmologique,
dû à l’expansion universelle .

- la mesure du champ magnétique : en 1896, Pieter Zeeman découvre que
la présence d’un champ magnétique important dédouble chaque niveau d’énergie
d’un atome . Les raies du spectre sont, elles, quadruplées car elles sont
fonction du niveau de départ et de celui d’arrivée . En fait, deux des
quatre raies sont trop proches, d’où l’on observe un triplet de raies .
Hale employa cette méthode pour montrer le champ magnétique associé aux
taches solaires, en 1908 .
|
|
|
- la température de l’objet.
Cependant, des perturbations dans la lecture des spectres peuvent être
introduites par la présence de plusieurs objets très rapprochés confondant
les émissions, par un trop grand nombre de molécules entraînant des raies
trop larges et superposées, par un fort rayonnement synchrotron (aplatissement
du spectre), par la capture d’électrons dans le milieu (spectre plat) .
Mais riche de ses possibilités, la spectrographie a été étendue en
1931 à la radioastronomie puis aux autres longueurs d’onde ; il s’agit
d’un outil extrêmement efficace auquel on doit bon nombre de théories de
premier plan, telle la nucléosynthèse à l’origine de la belle histoire de
la naissance, de la vie et de la mort des étoiles ...
Dans la théorie, Einstein fit un grand pas quand en 1905 il publia sa théorie des quanta ; il y associe à tout rayonnement de fréquence n des grains de lumière, ou quanta, dans l’énergie vaut h.n avec h constante de Planck, la longueur d’onde restant liée à cette fréquence par la relation l = c / n (c vitesse de la lumière) . Puis c’est Bohr qui, en 1913, imagine que les atomes se trouvent dans des états d’énergie discrets et que le passage d’un état énergétique excité à un état inférieur (ou inversement) doit s’accompagner de l’émission (resp. De l’absorption) d’un quanta d’énergie correspondante et de longueur d’onde donnée par la formule :
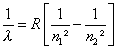
avec R constante de Rydberg (109677,58 cm-1)
. Concrètement, chaque atome possède des niveaux d’énergie, véritable
signature de l’élément . Les transitions entre niveaux ne sont possibles
qu’entre les niveaux considérés et selon des règles très rigoureuses . Par
conséquent, en étudiant les raies correspondantes aux ondes émises ou absorbées,
on peut identifier l’élément concerné . Par exemple, s’il s’agit
d’une raie sombre dans le spectre, il y a eu absorption d’énergie par l’élément
considéré ...
L’hydrogène est un cas tout à fait particulier ; il est
reconnaissable sur les spectres grâce à un certain nombre de séries caractéristiques
correspondante à des transitions entre les divers niveaux d’énergie . Ainsi
la raie Ha
est la plus célèbre en astronomie, car elle correspond à l’élément le
plus abondant et à la série observable dans le visible pour cet élément .
L’hydrogène est de loin le plus abondant des atomes de l’Univers, mais
l’hélium constitue environ 25 % de la matière observée et lui aussi
peut subir des ionisations : on appelle He I l’hélium une fois ionisé (perte
d’un électron) et He II l’hélium dépossédé de ses deux électrons donc
ionisé deux fois .
Partant de là, des difficultés surviennent parfois : l’hélium He II, pris dans certains états d’énergie (à partir du niveau n = 4), on obtient des valeurs de raies qui coïncident une fois sur deux au dixième de nanomètre près avec celles de l’hydrogène, ce qui n’est pas sans créer un problème dans l’identification .
| He II | (nm) | Hydrogène | |
| n1 = 4 | n2 = 6 | 656,0 | 656,3 |
| n2 = 8 | 485,9 | 486,1 | |
| n2 = 10 | 433,9 | 434,0 | |
| n2 = 12 | 410,0 | 410,1 | |
| n2 = 14 | 396,8 | 397,0 | |
Un autre problème est lié au décalage spectral lié lié au déplacement de la source lumineuse étudiée par rapport à l’observateur . Ce décalage est vers le rouge si la source s’éloigne et vers le bleu si elle se rapproche ; cela se traduit en pratique par un déplacement des raies (cf. Grandes Théories, Effet Doppler) dont on déduit la vitesse relative par simple lecture du décalage avec un étalon :
![]()
C’est de l’observation de nombreuses galaxies aux décalages presque
toujours orientés vers le rouge que Hubble et Humason déduirent la loi selon
laquelle le décalage augmente avec la distance : le quasar OQ172 a été mesuré
avec un z = 0,91, ce qui donne une vitesse de 273.000 km/s ... Mais cependant la
lecture de ces décalages n’est pas sans poser certains problèmes : il est fréquent
de détecter une série atomique dans un domaine de longueur d’onde où le détecteur
qui devait repérer la raie n’est plus efficace (la raie Ha
est décalée dans l’infrarouge par exemple) .
|
Elément |
Longueur d’onde (nm) |
Remarques |
|
O I |
777,2 et 844,6 |
|
|
C II |
426,7 |
|
|
C III |
465,0 |
étoiles type Wolf Rayet |
|
C IV |
580,1 et 581,2 |
|
|
Na
I |
589,0
et 589,6 |
|
|
Ca
I |
422,6 |
raie G du Soleil |
|
Ca II |
393,4 et 396,8 |
raies H et K du Soleil |
| Mg II | 448,1 | |
Raies spectrales les plus utiles en astrophysique
Spectres et structures atomiques
Pour chaque atome ou composé chimique, le spectre est une sorte
d’empreinte digitale .
Les scientifiques du siècle dernier ont établi un
inventaire des substances simples appelées éléments
chimiques constituées d’une seule espèce de particules indivisibles ou atomes
. Les innombrables autres substances sont toutes des combinaisons d’éléments,
des combinaisons d’unités formées par deux ou plusieurs atomes de nature
différente . Chaque atome est désigné par un symbole, et les molécules sont
désignées par une combinaison de ces symboles indicés du nombre d’atomes présents
: la molécule d’eau, composée d’un atome d’oxygène O pour deux atomes
d’hydrogène H, a pour formule H2O .
En 1859, Kirchhoff et Bunsen découvrirent que le spectre d’une substance simple, prise à l’état gazeux et à température élevée, consistait en un ensemble de raies lumineuses, lesquelles, selon leur position, leur intensité, étaient caractéristiques de chaque élément : les gaz irradient de la lumière dans des longueurs d’ondes déterminées.

Voir
aussi la
lumière et les ondes
Retour
aux questions de sciences