

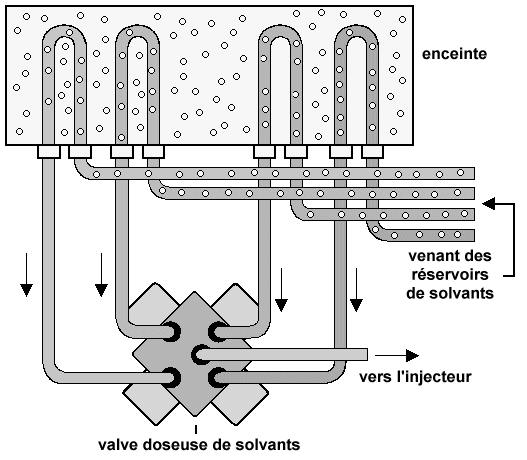
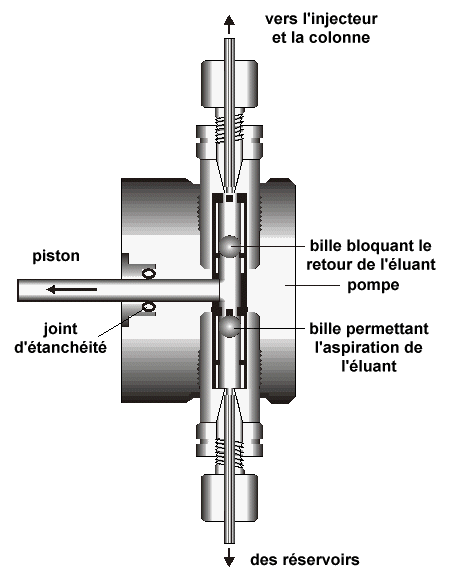
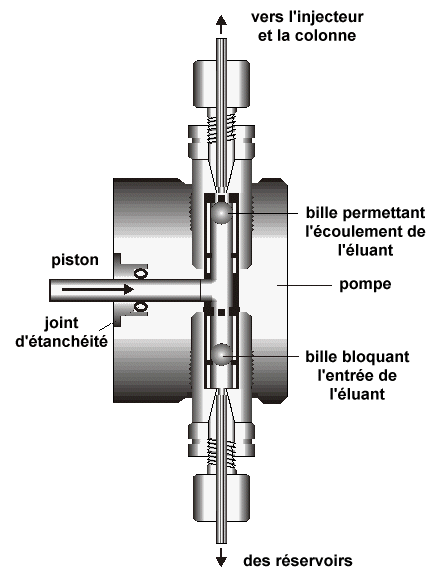


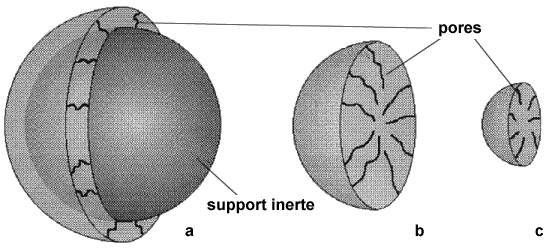
| Support poreux | ||
| support superficiellement poreux (figure 3.7 a) |
support poreux de faible diamètre (microparticules) (figure 3.7 b) et figure c) | |
| 30-45 mm avec pores peu profonds 1/30 à 1/40 de diamètre d'enveloppe poreuse - silice; - résines échangeuses d'ions. Surface 1 à 25 m2/g | diamètre de 20 à 40 mm avec pores profonds - peu efficace | diamètre de 5 à 10 mm avec pores peu profonds - surface 200 à 400 m2/g |
| avantages - transfert de masse rapide (vitesse d'échange
élevée); - ne s'écrase pas sous la pression. désavantage - peu de capacité (faible k') à cause des pores peu profonds, ce qui diminue les possibilités de séparation. |
avantages - permet l'utilisation de colonnes plus courtes et de pressions plus basses; - trajet réduit parcouru entre les particules; - remplissage en mélangeant avec le solvant; - capacité comparable à celle d'un support superficiellement poreux. | |
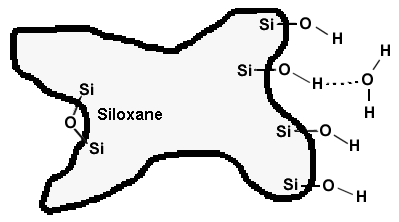
| Support non-poreux | |
| Puisque la surface de contact est
beaucoup moins grande (la moitié) que celle de support poreux, le diamètre des granules sphériques doit être plus petit, en fait entre 1 et 2 mm. Avantages: - conditionnement plus rapide en l’absence de pores; - temps de résidence sur la colonne est plus court, ce qui en fait un avantage dans le cas de séparation de substances biologiques sensibles; - plus faible consommation de solvant; - ne s'écrase pas sous la pression. |
 Figure 3.9. |
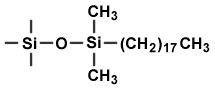
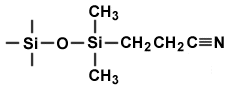
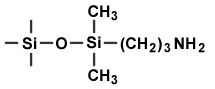
| la polarité du solvant augmente dans le sens de la flêche | |
| PHASE NORMALE adsorbant polaire et très polaire |
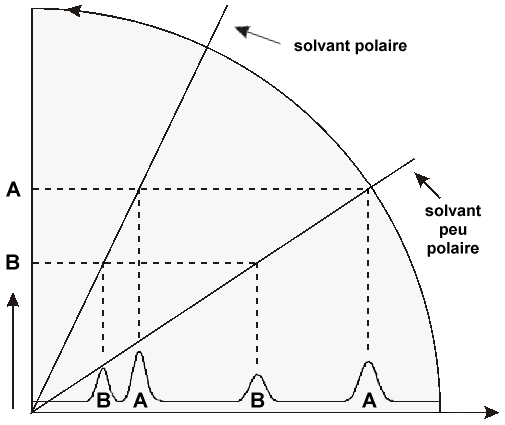 |
| la polarité
de l'échantillon augmente | |
| la polarité du solvant augmente dans le sens de la flêche | |
| PHASE INVERSÉE adsorbant peu polaire |
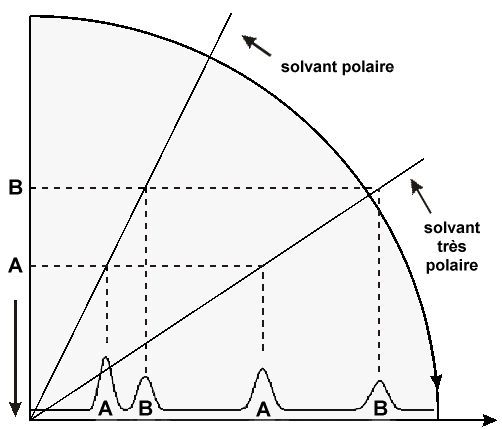 |
| la polarité
de l'échantillon augmente | |

| Propriétés de quelques solvants utiles en chromatographie phase liquide | |||||
| Solvant | UV
cutoff (nM) |
Viscosité (cP) |
Eb (oC) |
Indice de miscibilité (M) |
Polarité (P) |
| Isooctane | 215 | 0,50 | 99 | 29 | 0,1 |
| Hexane | 195 | 0,31 | 69 | 29 | 0,1 |
| Toluène | 284 | 0,59 | 111 | 23 | 2,4 |
| Méthyl-t-butyléther | 210 | 0,27 | 55 | - | 2,5 |
| Dichlorométhane | 233 | 0,44 | 40 | 20 | 3,1 |
| Propanol-1 | 210 | 2,30 | 97 | - | 4,0 |
| Tétrahydrofurane | 212 | 0,55 | 66 | 17 | 4,0 |
| Chloroforme | 245 | 0,57 | 61 | 19 | 4,1 |
| Éthanol | 210 | 1,08 | 78 | - | 4,3 |
| Acétate d'éthyle | 256 | 0,45 | 77 | 19 | 4,4 |
| 1,4-Dioxane | 215 | 1,37 | 101 | 17 | 4,8 |
| Acétone | 330 | 0,36 | 56 | 15 | 5,1 |
| Méthanol | 205 | 0,55 | 65 | - | 5,1 |
| Acétonitrile | 190 | 0,38 | 82 | 11 | 5,8 |
| Acide acétique | - | 1,10 | 118 | - | 6,0 |
| Eau | 190 | 1,00 | 100 | - | 10,20 |
| Microcolonne
remplie diamètre intérieur: 50 mM ou moins |
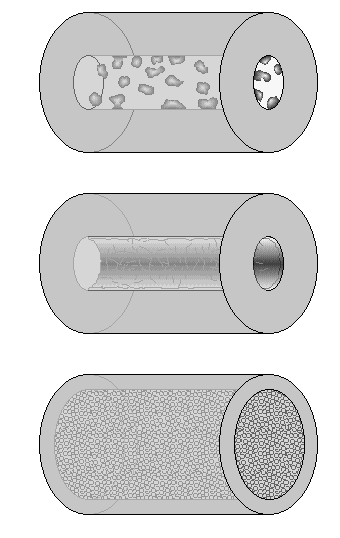 |
| Colonne du type
ouvert (open tubular) diamètre intérieur: 70 mM ou moins | |
| Colonne microbore
remplie d'un granulé enrobé de phase stationnaire diamètre intérieur: 1000 mM ou moins |

