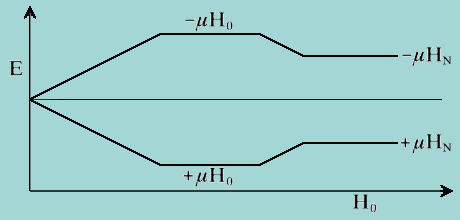


| Figure 2.1. Comparaison des
nivaux d'énergie d'un proton déblindé H0 et blindé
HN dans un champ magnétique appliqué.
|
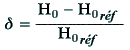
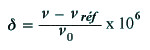
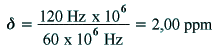

| Figure 2.2. À gauche un
proton dans un champ magnétique. À droite, le même système avec le champ
produit par les électrons.
|
| Protons du méthane | |||
| Nombre d'atome(s) de chlore sur le carbone du méthane | Déplacement chimique du (des) proton(s) du méthane (d) | Coefficient de corrélation | 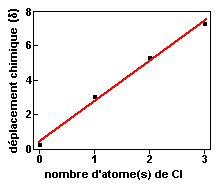 |
|---|---|---|---|
| 0 | 0,23 | 0,9933 | |
| 1,00 | 3,05 | ||
| 2,00 | 5,30 | ||
| 3,00 | 7,27 | ||
| Déplacement chimique des protons surdimensionnés (d) | ||||
| Halogène (X) | Électronégativité | CH3-X | CH3CH2-X | CH3CH2CH2-X |
| F | 3,98 | 4,27 | 4,36 | 4,30 |
| Cl | 3,16 | 3,06 | 3,47 | 3,30 |
| Br | 2,96 | 2,69 | 3,37 | 3,18 |
| I | 2,66 | 2,15 | 3,16 | 2,99 |
| coefficient de corrélation | 0,9984 | 0,9918 | 0,9884 | |
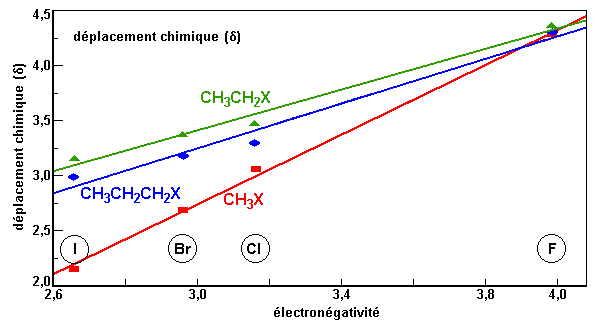
| Figure 2.4. Relation entre la
valeur d'électronégativité de l'halogène et le déplacement chimique des
protons de quelques composés.
|
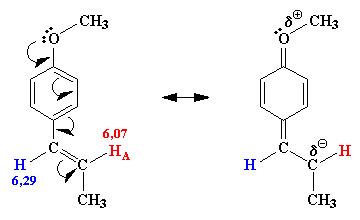
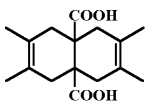
| Figure 2.5. Un diacide qui
forme une g,g-diiodolactone.
|
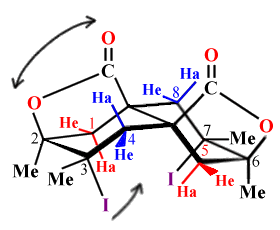 Figure 2.6. La dilactone. |
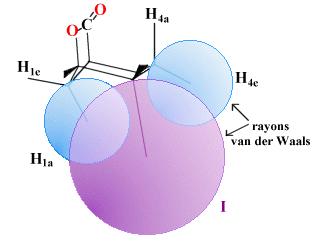 Figure 2.7. Le chevauchement des rayons de van der Waals. |
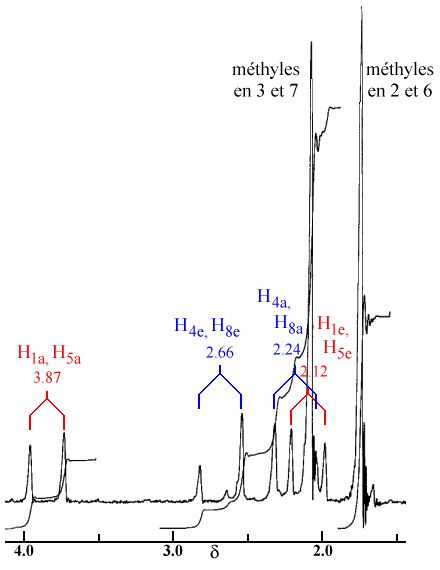
| Figure 2.8. Spectre de RMN de
la dilactone représentée en figure 2.6. Notez le déblindage des
protons 1 et 5 en position axiale et dans une moindre mesure
celle des protons 4 et 8 en position équatoriale.
|
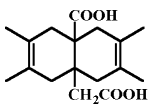
| Figure 2.9. Un diacide qui
forme une g,d-diiodolactone par deux bandes
caractéristiques à 1773 et 1733 cm-1.
|
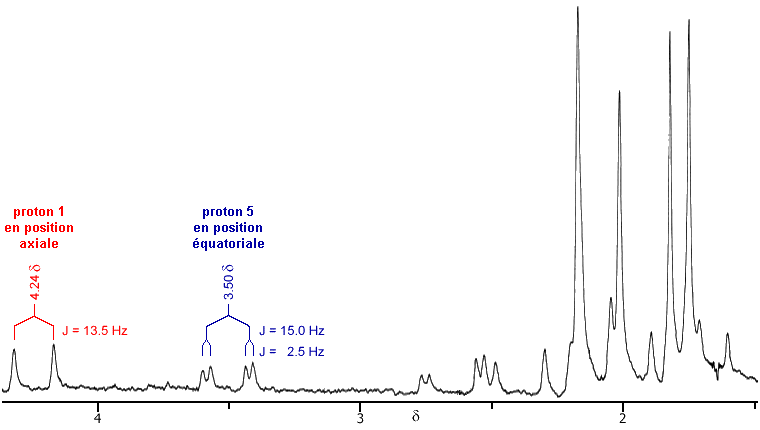
| Figure 2.10. Le spectre RMN
qui montre la différence qui existe entre la résonance du proton en
1 et celui en 5.
|

