La physique au temps de Sigaud de La Fond
Un état des lieux des connaissances scientifiques au siècle des Lumières
A la fin du Moyen-Âge, la société est en expansion. Les techniques facilitent l’utilisation des ressources de la nature et permettent de réaliser des outils de plus en plus complexes, posant aux esprits curieux des énigmes où se jouent des phénomènes fondamentaux : rôle des verres correcteurs, trajectoire des projectiles, équilibre et écoulement des liquides, rôle de la chaleur, etc. Pour accompagner le développement économique et commercial consécutif à cette évolution, il faut former les esprits : des universités naissent, lieux d’instruction et de formation, de réflexion, de critique et de recherche intellectuelle. Cette période portera très bien le nom de Renaissance.
Des progrès techniques très importants, des bouleversements philosophiques… mais la physique ne suit pas ce courant. Le retour à Platon, par opposition à Aristote compromis avec la scolastique de l’Eglise catholique, a conduit à mépriser les phénomènes matériels. La Réforme et les guerres de Religion durcissent les positions ; l’accueil réservé à la théorie de Copernic, et surtout le rejet des visions cosmologiques de Giordano Bruno prouvent le peu de cas que les autorités religieuses faisaient de la connaissance du monde. L’affaire Galilée ne viendra que confirmer cette rigidité. Le génial Léonard de Vinci (1452-1519) lui-même reste plus attaché aux dispositifs pratiques qu’aux principes sous-jacents. C’est en fait dans les mathématiques que cette époque verra les progrès les plus importants. Il convient tout de même de citer les travaux de Simon Stevin (1548-1620) sur la statique et l’hydrostatique, et ceux de William Gilbert (1544-1603) sur l’électrisation et la magnétisation, les travaux de ce dernier étant repris par Kepler (suggestion d’une attraction Terre-Soleil) puis par Newton (dans les Principia et dans son traité d’optique).
C’est au cours du XVIIème siècle que s’est produit le bouleversement qu’on a finalement appelé la Révolution scientifique. Si les études en mathématiques ou en astronomie étaient déjà bien avancées, si des penseurs comme Roger Bacon avaient déjà préconisé l’observation et l’expérimentation au lieu de l’étude des œuvres d’Aristote, il y a bien eu révolution, en la matière de l’œuvre de Galilée, qui inspira une impulsion décisive poursuivie ensuite par Newton.
Les savants européens, qu’ils soient mathématiciens, physiciens, philosophes, voire ingénieurs (les clivages n’étaient pas si nets à l’époque) ont constitué un réseau informel, échangeant lettres, visites, défis et polémiques. Ainsi, avant même que Newton ne théorise la gravitation universelle, l’activité scientifique se développe rapidement. La Royal Society de Londres apparaît en 1645, l’Académie des Sciences de Paris en 1665. Quelques années plus tard naissent les premiers journaux savants, diffusés dans l’Europe entière. Les différentes branches de la physique sont l’objet d’expériences systématiques et de théories mathématisées sur le modèle de la mécanique céleste. Tous ces progrès parallèles conduiront, à la fin du XIXème siècle, à ce qu’on appellera rétrospectivement la physique classique.
La
mécanique
La thermodynamique
L'optique
L'électricité, le magnétisme
L'astronomie
La chimie
Vous pouvez dérouler le menu de gauche "Physique"
La
mécanique
La légende dit que Galilée
(1564 −
1642) aurait découvert les lois du pendule à l’âge de 19 ans en observant les
oscillations du lustre de la cathédrale de Pise. Le prodige ne s’arrête pas là :
il étudie la cycloïde, formule les lois de la chute des corps en montrant que la
trajectoire d’un projectile est une parabole, réalise l’un des premiers
microscopes et effectue les premières observations du ciel à la lunette.
Depuis Aristote, on distinguait les mouvements naturels – selon l’axe vertical
de la chute des corps – des mouvements provoqués, considérés – comme tout
changement – comme dépendants d’une cause et donc voués à disparaître lorsque
cette dernière cessait. Cette conception était évidemment infirmée par des
constats simples : la vitesse horizontale des boulets de canon sur une
trajectoire donnée est presque constante ; il n’y a pas de discontinuité entre
la phase ascendante et la phase descendante de cette trajectoire...
La notion médiévale d’impetus liée à l’objet en mouvement permettait
d’éviter de recourir à des causes improbables (comme une rétropression de l’air)
mais cette notion, qualitative, ne donnait pas le moyen de déterminer avec
précision la trajectoire.
Galilée choisit ses hypothèses non pas en fonction de leur évidence, mais sur
leur capacité à donner une prédiction. Pour la chute des corps, par exemple, il
postule l’existence d’une accélération constante – l’actuelle pesanteur – et
montre que, soumis à cette accélération, la vitesse des corps en chute augmente
proportionnellement à la durée de chute ; il vérifie cela en mesurant des temps
de parcours sur plans inclinés en se servant de son pouls pour montre. Sa
réflexion sur la chute d’un objet du haut du mât d’un navire l’a convaincu de ce
qu’on appelle aujourd’hui le principe d’inertie : tout corps en mouvement
continue indéfiniment en ligne droite à vitesse constante tant qu’il n’est pas
soumis à une force externe. La combinaison de ce mouvement horizontal, constant,
avec le mouvement vertical uniformément accéléré engendre une trajectoire en
forme de parabole. Si cette courbe est bien connue des mathématiciens, elle est
qui plus en accord avec l’expérience des artilleurs.
Galilée substitue au fatras de considérations qualitatives de ses prédécesseurs
des concepts clairs et univoques – position, inertie, vitesse instantanée,
accélération – et confronte les résultats de ses raisonnements, sous forme
mathématique, à des données expérimentales bien définies (et non à de prétendues
évidences logiques). Fait nouveau : la correspondance entre les mathématiques et
la réalité n’est plus seulement symbolique ou qualitative, elle est vérifiée
point par point par l’expérience. C’est en cela que Galilée est souvent
considéré comme le premier physicien au sens moderne du terme.
 |
Une bille est lâchée d’une
table, avec plus ou moins de vitesse initiale (horizontale). Galilée
dessine alors sa trajectoire, parabolique, mais surtout repère la
distance à laquelle la bille atterrit. Ce feuillet est bien un
compte-rendu d’expérience. Crédits : Folio 116. Bibliothèque centrale de Florence, feuillets non publiés. |
La physique de
Descartes
(1596 – 1650) est exposée dans le Monde, un ouvrage de 1663 qu’il ne
publiera pas à cause de la toute récente condamnation de Galilée. Elle est avant
tout fondée sur l’identification de la matière avec la quantité géométrique (materia
vel quantitas) ; sont ainsi écartées du monde physique les formes
substantielles et les qualités de la scolastique : pesanteur et mouvement sont
ramenés à des explications mécanistes. La description est avant tout cinématique
(pas de force ou d’action à distance), le mouvement se transmettant de proche en
proche par contact. L’Univers, dans lequel le vide n’existe pas, est rempli
d’une substance animée de tourbillons. Toute action « occulte » étant exclue de
ce mouvement, il doit être conservé dans sa totalité par le pouvoir conservateur
de Dieu. Si un corps perd du mouvement, il le transmet à un autre. Le principe
d’inertie est là encore clairement affirmé par Descartes. Au sein de ce système,
la théorie des chocs joue un rôle particulier : c’est elle qui serait en effet
susceptible de permettre des calculs prévisionnels de mouvement. Bien que de
manière globalement erronée, Descartes introduira la notion de quantité de
mouvement et sa conservation.
Descartes rejette le vide, car « il n’est pas possible que ce qui n’est rien
ait de l’extension » (Principes de philosophie, n°16) : si un vase
est vide d’eau, il est plein d’air, et s’il était vide de toute substance, ses
parois se toucheraient. Torricelli mettra un terme à cette « horreur du vide »
par ses travaux sur la pression et le problème des puisatiers de Florence.
Descartes rejette complètement les théories des atomistes. Le mouvement des
planètes s’explique par de grands tourbillons d’éther remplissant l’espace qui
les emportent et les maintiennent sur leurs trajectoires. Ses travaux en optique
furent particulièrement fructueux, notamment sur le phénomène de réfraction de
la lumière. Sur ce dernier sujet, il bataillera ferme contre un autre
scientifique de grand renom, Pierre de Fermat (1601 – 1665), qui expliquera la
composition des forces selon la règle du parallélogramme.
| Illustration de l'Univers selon Descartes. Chaque "gros corps massif" (planète ou étoile) est entouré d'un tourbillon de "fluide étheré" responsable de l'attraction qu'exerce sur les petits objets l'astre dominant. De la même façon, le mouvement tourbillonnant est censé expliquer la répulsion entre les astres massifs, qui restent donc à distance importante les uns des autres. |
 |
Ami de Descartes et
admirateur de Galilée, le néerlandais Christiaan
Huygens (1629 – 1695) marqua
son époque de nombreuses découvertes. Astronome chevronné, il identifie les
anneaux de Saturne en tant que tels (Galilée y voyait des satellites). Toute sa
vie, il s’intéressera au pendule comme instrument de mesure du temps et des
longitudes : il découvre l’isochronisme des petites oscillations du pendule et
invente l’échappement, dispositif mécanique permettant de rendre constante la
vitesse d’une horloge grâce à un pendule dont il entretient le mouvement ; il
invente également un pendule spirale portatif.
Huygens touche à la définition actuelle du moment d’inertie utilisée dans
l’étude de la rotation des corps.
Pour Huygens, la lumière est constituée de vibrations longitudinales, et non de
corpuscules comme Newton le suppose : l’idée fondamentale est que chaque point
du front d’onde qui se propage devient à son tour la source d’une nouvelle onde,
et le phénomène lumineux est constitué de l’enveloppe de ces ondelettes!; S’il
ne parvient pas à éclaircir les concepts d’interférences ou de déphasage, il
réalise toutefois les premières expériences démontrant la polarisation de la
lumière et sa double réfraction.
Huygens fait d’importantes contributions en mathématiques (calcul infinitésimal)
et invente le manomètre.
 |
La courbe isochrone selon Huygens |
Si Galilée ou Huygens avaient pressenti la gravitation, il leur manquait l’outil mathématique adéquat pour la décrire. Le calcul des fluxions développé par Newton (1642 – 1727), où il considère les quantités finies comme engendrées par un flux continuel (bases d’un calcul infinitésimal), lui fournit un système unique d’équations décrivant aussi bien les mouvements des astres que celui d’une pomme qui tombe ou d’un boulet de canon projeté à grande distance. Le concept d’attraction universelle est très mal accueilli par une bonne partie du monde scientifique, notamment par les cartésiens qui tournaient en dérision le principe d’une action à distance (avec laquelle Newton n’était pas à l’aise, cela dit – et il faudra attendre le XIXème siècle pour que le concept de champ rende la pilule plus facile à avaler). Les britanniques n’exploiteront pas vraiment les résultats de leur compatriote et ce sont les mathématiciens français, grâce aux Lettres philosophiques (1734) de Voltaire notamment, qui vont réellement développer la mécanique newtonienne. Cette dernière englobe la conservation de la quantité de mouvement due à Descartes et celle de l’énergie cinétique apportée par Leibniz.

A y regarder de plus près, le travail de Newton constitue la première grande unification de la physique : à partir d’un élément central (la gravitation universelle), en reprenant les assertions de Galilée, il a regroupé dans un formalisme mathématique cohérent l’ensemble des phénomènes régissant les mouvements des corps pesants, célestes ou terrestre. Ses mathématiques, complexes (voire ésotériques), seront supplantées par celles de Leibniz, plus puissantes, et au formalisme plus accessible.
Newton théorise également la propagation du son dans l’air, aux côtés de Leonhard Euler (1707 – 1783) ; Jean Le Rond d’Alembert (1717 – 1783) et Joseph Louis Lagrange (1736 – 1813) développeront les équations des phénomènes périodiques (notamment acoustiques).
La pénétration des idées newtoniennes en France est lente. Pierre Moreau de Maupertuis écrira : "il a fallu plus d'un demi-siècle pour apprivoiser les académies du continent avec l'attraction. Elle demeurait renfermée dans son île ; ou si elle passait la mer, elle ne paraissait que la reproduction d'un monstre qui venait d'être proscrit ; on s'applaudissait tant d'avoir banni de la philosophie les qualités occultes, on avait tant peur qu'elles revinssent, que tout ce que l'on croyait avoir quelque ressemblance avec elles effrayait ; on est si charmé d'avoir introduit dans l'explication de la nature une apparence de mécanisme qu'on rejetait, sans l'écouter, le véritable mécanisme qui venait s'offrir."
La naissance de la physique expérimentale, et le rôle central accordé à l'expérience, sonnera le glas des dernières réminiscences des théories aristotéliciennes et de la plupart des concepts cartésiens - ces dernières étant liés à l'enseignement jésuite moribond. La puissance de la mécanique newtonienne, associée au développement d'outils de calcul plus perfectionnés, entérinera définitivement la prépondérance de la mécanique en tant que science expérimentale.
La
thermodynamique
Fusion, évaporation, opérations chimiques… Depuis bien longtemps, le rôle de la chaleur attire l’attention des savants. Plusieurs physiciens contemporains de Galilée distinguaient chaleur et température, et avaient même copié le thermoscope de Héron d’Alexandrie (la dilatation d’un gaz sert à évaluer les températures).
Les travaux du britannique Robert Boyle (1627 – 1691) et du français Edme Mariotte (1620 – 1684) montrent que le volume d’un gaz dépend non seulement de la température, mais aussi de la pression : en conséquence, l’indication de température du thermoscope dépend de la pression atmosphérique et il semble plus judicieux d’y utiliser des liquides insensibles à la pression.
Concernant les échelles de
température, c’est avant tout la question des repères fixes qui se pose : Edmund
Halley (1656 – 1742) puis Guillaume Amontons (1663 – 1705) observèrent que,
pendant toute la durée de l’ébullition ou de la fusion, la température de l’eau
reste constante. Après plusieurs tentatives, c’est le danois Ole Römer (1644 –
1710) – celui qui a réalisé la première mesure de la vitesse de la lumière – qui
fabrique le premier thermomètre à alcool étalonné en 60 degrés sur la fusion de
la glace et l’ébullition de l’eau ; René Antoine Ferchault de
Réaumur (1683 –
1757) lui donnera 80 degrés. L’allemand Daniel Gabriel
Fahrenheit (1686 – 1736)
a choisi des références différentes : 96 degrés entre la température la plus
basse atteinte à l’hiver 1708-1709 dans sa ville natale (Danzig) et la
température du sang.
Le suédois Anders
Celsius (1701 – 1744) utilisera une échelle de 100 degrés
entre l’ébullition de l’eau (0°C) et sa fusion (100°C), échelle qui sera
inversée par son compatriote Carl
von Linné ; le mercure, facilement purifiable
et ne se vaporisant qu’à haute température, est le liquide alors le plus
utilisé.
L’étude la dilatation (changement de volume des corps sous l’action de la
température, ou thermométrie) fait l’objet de nombreux travaux sur les solides (Deluc
en 1772, Lavoisier et Laplace), sur les liquides et surtout sur les gaz.
La question de la nature de la chaleur a longtemps fait débat. Comme pour la lumière, deux conceptions s’affrontent : pour les uns, la chaleur consiste en des vibrations au sein de la matière ; pour d’autres, en un « fluide impondérable ». C’est à partir de cette dernière hypothèse que la néerlandais Herman Boerhaave (1668 – 1738) postule la conservation de la chaleur. Le britannique Joseph Black (1728 – 1799) clarifie plusieurs concepts importants par des expériences systématiques, utilisant le thermomètre, mélangeant des liquides de températures différentes, faisant fondre des solides. Il montre que des corps différents absorbent plus ou moins de chaleur pour une même élévation de température, d’où la notion de capacité calorifique (ou chaleur spécifique) – capacité d’un corps à absorber (ou à délivrer) de la chaleur. Il étudie et mesure également la chaleur nécessaire pour faire fondre la glace ou transformer l’eau en vapeur – c’est le concept de chaleur latente, qu’utilisera notamment sont compatriote James Watt (1736 – 1819) pour inventer le condenseur.

Si Torricelli invente le baromètre, c’est Blaise Pascal (1623 – 1662) qui, informé de cette découverte, en profite pour démontrer l’existence du vide, brisant les tabous datant d’Aristote et perpétués par Descartes. L’action de la pression atmosphérique est démontrée de façon évidente par son expérience (menée par son beau-frère Perrier) au sommet du Puy de Dôme en 1648 : l’espace situé au-dessus du mercure dans un tube barométrique ne contient pas de matière !

La première pompe capable de produire facilement du vide est construite par l’allemand Otto Von Guericke (1602 – 1686) ; il l’utilisa pour démontrer que l’air est nécessaire à la vie, à la combustion et à la propagation du son. L’expérience des hémisphères de Magdebourg, en 1654, reste également très célèbre. Il montre enfin qu’en faisant le vide derrière un piston, la pression atmosphérique peut être utilisée pour produire du mouvement et du travail. En 1690, le français Denis Papin, après plusieurs tentatives, parvient à produire du travail par la condensation de vapeur d’eau enfermée dans un cylindre chauffé muni d’un piston (la « marmite » de Papin) : ce résultat sera source d’inspiration pour de nombreux chercheurs.

L’anglais Thomas Newcomen (1663 – 1729) construit la première machine à pompage atmosphérique en 1712 ; elle sera utilisée dans une mine pour évacuer l’eau.
En inventant en 1764 le condenseur, qui liquéfie la vapeur sans refroidit le cylindre, James Watt augmente considérablement le rendement de la pompe de Newcomen. Il s’agit toutefois toujours d’une machine où le travail est dû à la pression atmosphérique ; Watt imagine de la remplacer par celle de la vapeur pour actionner le piston : la machine à vapeur était née. Watt invente également le régulateur et la machine à double effet ; il améliore le système bielle-manivelle. Ses successeurs poursuivront ses travaux avec la haute pression, ce qui permettra de réduire l’encombrement et d’envisager une utilisation sur les véhicules.
Ces travaux d’ingénierie constituent l’une des plus importantes avancées de la connaissance expérimentale du XVIIIème siècle ; c’est de l’étude de la machine à vapeur qu’est née la thermodynamique, l’une des sciences reines du siècle suivant. A la fin du siècle, la connaissance des propriétés des gaz et le goût de l’aventure donnent lieu aux première expériences d’aérostation : celles de Joseph et Etienne de Montgolfier (1782) et de Pilâtre de Rozier (1783), qui utilisent la dilatation de l’air chaud, et celles de Jacques Charles (1783), qui tire parti de la faible densité de l’hydrogène, un gaz dont la découverte est alors récente.
Au début du XVIIIème siècle, l’allemand Georg Ernst Stahl développe la théorie du phlogistique, une substance hypothétique qui serait enfermée dans tous les corps combustibles et libérée lors de la combustion. Chauffées avec le charbon, corps constitué de phlogistique presque pur, les oxydes métalliques pourraient récupérer leur phlogistique. Cette théorie, qui explique qualitativement de nombreuses transformations chimiques, sera invalidée par Antoine Laurent de Lavoisier (1743 – 1794) : celui-ci, utilisant la balance pour établir les bilans de matière dans les réactions chimiques, observe que les oxydes pèsent plus lourd que les métaux dont ils proviennent : la combustion n’est donc pas une perte de phlogistique, elle correspond à la fixation d’oxygène.
L’hypothèse d’une substance de la chaleur – le calorique – subsiste en revanche et Lavoisier lui-même la soutient. On attribue à l’anglais Benjamin Thompson, comte Rumford (1753 – 1814) une observation déterminante dans l’abandon de ce calorique : lorsqu’on forge l’âme d’un canon, ce qui demande une énergie considérable, il se dégage beaucoup de chaleur. D’où vient-elle ? Est-elle stockée dans le métal ? Il remarque parallèlement que l’usage d’un outil ébréché accroît le travail nécessaire et la chaleur dégagée. Il semble que ce soit, comme pour le mouvement, le travail même qui produise cette chaleur, et non qu’elle provienne d’un stock de calorique caché dans le métal. Rumford donne même une première estimation du rapport entre le travail et la chaleur. Cette constatation va contribuer à constater l’équivalence chaleur-travail, postulat central de la thermodynamique.
Poursuivant l’œuvre de Rumford, le britannique Humphrey Davy (1778 – 1829) montre que deux blocs de glace fondent quand on les frotte l’un contre l’autre. Cette expérience semble récuser la théorie affirmant que la chaleur est de nature matérielle. Celle-ci restera toutefois admise par de nombreux chercheurs comme Fourier (conduction de la chaleur) ou Laplace (propagation du son, vibration sans échange de chaleur). Si la compréhension des phénomènes s’étend, ce n’est qu’au cours du XIXème siècle que la correspondance chaleur-travail sera définitivement admise.
L’optique
La lumière est un phénomène naturel à la fois familier et spectaculaire. Grâce à la sensibilité et à la finesse de perception de l’œil, elle nous révèle les formes, les couleurs et les mouvements des êtres et des choses avec une extrême fidélité. Elle n’a pas été classé par les Grecs de l’Antiquité parmi les quatre (ou cinq) éléments primordiaux, mais ses propriétés exceptionnelles en faisaient déjà pour eux une entité à part, une sorte de feu idéal. De nombreux peuples lui ont attribué un caractère surnaturel, voire divin. Aujourd’hui encore, elle est source de métaphores et d’identification religieuses ou mystiques. Son origine même suscite des questionnements. Vient-elle de l’œil qui regarde ? De l’objet regardé ? A la suite de Pythagore, d’Aristote ou encore d’Euclide, de nombreux savants se sont interrogés sur sa nature et ses propriétés.
La notion de rayons lumineux qui permettra à l’optique de faire des progrès considérables s’est longtemps opposée à celle des « rayons visuels » La théorie d’un rayon visuel émis par l’œil est due aux pythagoriciens. Le fait qu’un chat par exemple, soit doué d’une certaine « vision nocturne » constituait une « preuve » de l’existence de ces rayons. Les atomistes et Empédocle avaient, quant à eux, développé l’idée de rayons lumineux émanant de tous les objets. C’est grâce à Alhazen (965-1039), fondateur de l’optique moderne que l’idée des rayons de lumière émis par des sources, réfléchis et réfractés par des objets, s’est définitivement imposée. Le rayon visuel et le rayon lumineux finalement étaient en fin de compte constitués des mêmes segments de droite. Seule l’interprétation relative à l’origine physique de ces rayons est différente. C’est avec Euclide (325-265) qu’est née véritablement l’optique géométrique : dans son traité d’optique, il établit les lois de la réflexion des rayons lumineux.
Au XVIIème siècle, il est à peu près acquis que les sources de lumière sont les astres (surtout le Soleil), les flammes et quelques phénomènes transitoires comme l’éclair ; que les objets éclairés la renvoient plus ou moins colorée ; qu’elle se propage en ligne droite ; qu’elle peut subir des réflexions (sur une surface métallique, sur une vitre) et des réfractions (en passant d’un milieu transparent à un autre). Ce qu’on ignore en revanche, c’est pourquoi la lumière blanche permet de voir la couleur et la nature des objets qu’elle éclaire. Est-ce une propriété de la lumière ? De l’objet ? Pour certains, la lumière est constituée de particules très fines, pour d’autres elle correspond à une espèce d’ébranlement du milieu – analogue au son –, chacune de ces options expliquant assez bien une partie de ses propriétés. Sur le plan pratique, miroirs et lentilles sont utilisées depuis Archimède, mais la maîtrise de leur fabrication s’accroît grandement au XVIème siècle et permet d’associer plusieurs lentilles pour combiner leurs propriétés : c’est ainsi que sont construites les lunettes grâce auxquelles Galilée peut observer les astres.
Ce sont les rayons lumineux, réfractés, qui confèrent aux lentilles leurs propriétés (convergence ou divergence). C’est le néerlandais Willebrod Snell (1580 – 1626) qui découvre le premier la constance du rapport entre les sinus des angles incident et réfracté ; cette « loi des sinus » sera reprise par d’autres, comme Descartes ou Huygens.
Pour Descartes, la lumière vient de la vibration des particules qui remplissent l’espace : plus le milieu est dense, et plus elle est rapide (ce qui est faux). Pour Huygens, la lumière est une suite d’ondes de choc qui se produisent dans l’éther à une vitesse très élevée (mais finie comme le montrera le danois Ole Römer en 1676) : chaque onde engendre sur son parcours des ondes secondaires dont l’enveloppe forme un front d’onde qui lui permet d’expliquer la propagation en ligne droite, la réflexion et la réfraction (mais pas la couleur) ; l’observation de l’irisation en bordure des ombres portées par l’italien Grimaldi (1618 – 1663) plaide en faveur de la théorie de Huygens.
La question de la nature de la couleur de la lumière est épineuse : s’agit-il d’une propriété intrinsèque, ou bien d’une altération ? Robert Hooke (1635 – 1703) s’intéresse aux couleurs produites par la lumière blanche sur les lames minces, par les lentilles et par le prisme.

Dès 1670, Newton travaille à une théorie de la lumière qu’il ne diffusera qu’en 1704 dans son Optique. Il critique vivement les positions de Huygens et défend une lumière constituée de corpuscules qui se réfléchissent, se réfractent et se mettent à vibrer en donnant les figures de diffraction ou de franges colorées observées. S’intéressant à la décomposition de la lumière blanche par le prisme, il montre expérimentalement que le mélange de ces couleurs reconstitue la lumière blanche initiale ; il explique la décomposition sous incidence donnée par le fait que la lumière est réfractée à des angles légèrement différents selon sa couleur. Toutefois, pour lui, tous les milieux transparents ont des indices relatifs aux différentes couleurs dans le même ordre, ce qui rend impossible la fabrication d’achromats (c’est ce qu’on a appelé « l’erreur de Newton » ; autour de 1750, Euler puis Chester Hall (1703 – 1771) montrèrent que la dispersion des couleurs n’est pas la même pour tous les milieux. Son « erreur » poussa Newton à inventer un télescope achromatique ; en utilisant le fait que la réflexion sur les miroirs reste indépendante de la couleur, le télescope utilise des miroirs courbes et non des lentilles. Newton expliqua également l’apparition d’anneaux colorés au contact d’une surface plane et d’une surface convexe.
En 1669, le danois Erasmus Bartholin met en évidence la biréfringence du spath d’Islande : un simple rayon lumineux traversant ce cristal selon certaines directions se scinde en deux pinceaux de lumière dont l’un seulement obéit à la loi des sinus ; Huygens prolongera ce résultat avec un deuxième cristal, en obtenant deux ou quatre faisceaux.
La théorie corpusculaire, soutenue par Newton et malgré ses faiblesses (sur la diffraction, entre autres), permettra le développement de l’optique géométrique et, avec elle, celui d’instruments d’optique de plus en plus puissants et de meilleure qualité.
Le français Pierre Bouguer (1698 – 1758), inventeur du premier photomètre, a également découvert que l’intensité émise par une source diminue proportionnellement au carré de la distance à cette source.
Le
siècle suivant verra le triomphe de la théorie ondulatoire.
L’électricité, le magnétisme
En 1660, Otto von Guericke – déjà connu pour ses travaux sur le vide et la pression atmosphérique – reprend les expériences sur le magnétisme conduites par William Gilbert au Moyen-Âge, en utilisant une sphère remplie d’une bonne quantité de soufre mélangée à des produits magnétiques. Frottée, une telle sphère attire de petits objets et émet des étincelles. Il réitère l’expérience avec une sphère entièrement remplie de soufre, fabriquant ainsi la première machine électrostatique, sans réellement comprendre qu’il avait affaire à des phénomènes électriques. Il constate également qu’une brindille d’abord attirée par l’ambre est ensuite violemment repoussée par celle-ci après avoir été mise à son contact.
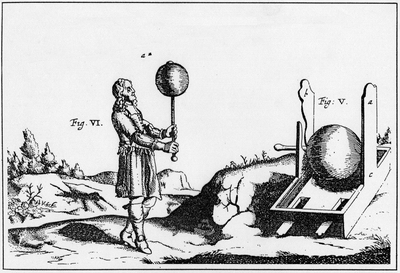
O. van Guericke,
Experimenta nova, 1672, Magdebourg
Au début du XVIIIème siècle, Francis Hauksbee (1666 −1713) construit, à partir d’une boule de verre, une machine produisant par frottement de l’électricité statique et capable de générer des étincelles de grande dimension. Son étude sur le tube barométrique lui permet de constater qu’en agitant le mercure, la partie vide se remplit de lueurs : il interprète cela par le frottement du mercure sur les parois du tube. Ses expériences vont accentuer la différence entre l’électricité statique, produite par frottement, et le magnétisme, propriété naturelle transmissible par influence.
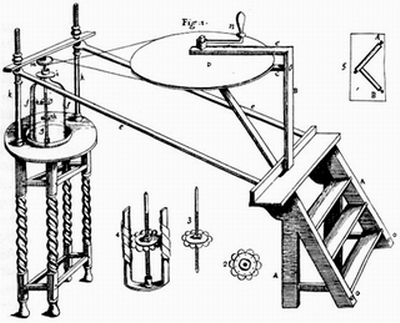
Hauksbee, several experiments on the attrition of bodies in vacuo, Phil. Tr.
24, 1704-1705.
Le cylindre de verre est placé au-dessus d'une pompe à vide (non représentée sur ce dessin). Des perles d'ambre frottent sur des tampons de laine.. Le mouvement est transmis par une courroie de la grande roue de 60 cm de diamètre à la petite poulie fixée au sommet du dispositif.
Le britannique Jesse Ramsden (1735 − 1800), célèbre fabricant d’instruments, perfectionne les machines électrostatiques à frottement en imaginant un dispositif formé de deux récipients de verre tournants.
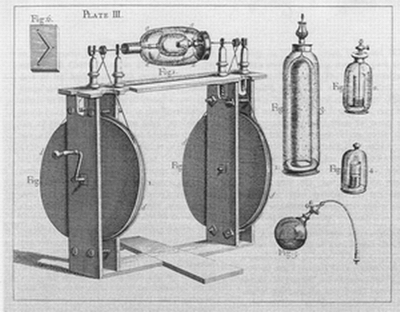
Hauksbee,
Physico-mechanical experiments on various subjects, 1709.
Les deux cylindres de verres de cette machine peuvent être mis en rotation indépendamment l'un de l'autre. On fait le vide dans le cylindre intérieur. Lorsqu'on applique une main bien sèche sur le cylindre extérieur en rotation, une lueur apparaît dans le cylindre intérieur.

Machine électrique ordinaire de
Ramsden, Traité de physique élémentaire de Drion et Fernet (1893).
La machine à disque vertical tournant, dite de Ramsden, s'impose dans les années 1780, jusqu'à la fin du XIXe siècle où elle est encore présentée dans les manuels scolaires comme "la plus ordinairement employée".
L’étude systématique des phénomènes électrostatiques démarre dans les années 1720, lorsque l’anglais Stephen Gray (1670 − 1736) construit une machine électrique encore améliorée, et démontre que la « vertu » électrique peut être transportée d’un corps électriquement chargé à un autre non chargé, à l’aide de fils de métal ou même du corps humain. Il distingue les corps conducteurs (comme les métaux) des corps isolants (comme le verre et le soufre), et parvient à transmettre l’électricité par influence, sans contact direct.
Le français Charles François Cisternay du Fay (1698 – 1739) met en évidence deux formes d’électricité : celles produites par frottement de corps transparents (cristal, verre) dites électricité vitrée, et celles qui proviennent de corps résineux ou bitumeux, l’électricité résineuse. Chacune de ces deux formes repousse les corps portant une charge de même type et attire ceux portant la charge opposée. Avec son élève puis collaborateur, l’abbé Jean-Antoine Nollet (1700 – 1770), Du Fay réalise de spectaculaires démonstrations – par exemple, suspendu à des fils de soie et électrisé, il fait jaillir des étincelles entre sa main et celle de son assistant.

Louis Figuier, Les merveilles de la science, 1867 (t.1, p.447)
L’abbé Nollet deviendra ensuite célèbre grâce à ses talents de démonstrateur et à la publication, en 1764, de ses Leçons de physique expérimentale, en six volumes, qui popularisent les phénomènes électriques.

Louis Figuier, Les merveilles de la science, 1867 (tome 1)
Ewald Jürgen von Kleist (1700 − 1748) puis, vers 1746, Petrus van Musschenbroek (1692 − 1761) – connu pour avoir ressenti la première commotion électrique – découvrent que le « fluide électrique » peut être stocké dans ce qu’ils appellent des « bouteilles de Leyde » ; celles-ci – les ancêtres du condensateur – sont constituées de deux surfaces conductrices séparées par une épaisseur de verre ; leur capacité ne dépend pas de leur volume, mais est proportionnelle à la surface du verre et inversement proportionnelle à son épaisseur. Moyennant des montages en parallèle ou en série, il devient possible d’étudier la décharge de ces bouteilles et la conduction du courant électrique.
Benjamin Franklin (1706 − 1790), l’un des premiers savants américains, échafaude une théorie de ces instruments. Pour lui, le fluide électrique est unique et c’est son excès ou son déficit qui engendre les deux formes d’électricité, vitrée et résineuse. Il précise la notion de charge électrique et énonce le principe de la conservation de la charge. Dans ses célèbres expériences avec des cerfs-volants, il capte l’électricité atmosphérique et montre qu’elle est de même nature que l’électricité statique obtenue par frottement, comme le laissent penser les similitudes entre éclairs et étincelles électriques.
Observant les propriétés des pointes métalliques, Franklin invente le paratonnerre en 1752. Le physicien russe Georg Wilhelm Richmann (1771 – 1753), répétant l’expérience du cerf-volant, meurt électrocuté, ce qui révèle les dangers réels du « fluide électrique ».
En dépit de ces observations, la question de la nature de l’électricité reste assez confuse. Pour certains, il s’agit d’un fluide très ténu, composé de particules capables de pénétrer même la matière la plus dense ; alors que les particules qui composent la matière solide se lient fortement, les « particules électriques » se repoussent : la charge électrique d’un corps repose sur un excès ou sur un déficit de ces particules. Pour d’autres, deux fluides, correspondant respectivement aux électricités vitreuse et résineuse, sont répartis en quantités égales dans les corps neutres ; le déplacement d’un de ces fluides provoque les phénomènes d’électrisation et d’influence. C’est à partir de cette théorie que le français Charles de Coulomb (1736 – 1806) établit la loi de l’inverse carré. Celle-ci, proposée par le britannique Joseph Priestley (1733 - 1804), avait été pressentie par Franklin, et également établie par le britannique Joseph Robinson puis par son compatriote Henry Cavendish (1731 – 1810), qui négligea de la publier. Elle s’inspire évidemment de la loi d’attraction des masses de Newton. Coulomb, ingénieur très minutieux, étudie les phénomènes de frottement et met au point une balance de torsion très sensible capable de mesurer des forces grâce à la torsion d’un fil métallique élastique. Placée dans une cage de verre, cette balance lui permet de mesurer la répulsion ou l’attraction entre deux charges électriques séparées par une distance qu’on peut ajuster et mesurer. Ces expériences sont si délicates que la précision des résultats de Coulomb a été mise en doute ; elles ont néanmoins permis d’affiner la notion de charge électrique et d’établir le fait qu’elles obéissent à l loi de l’inverse carré. Parallèlement, Cavendish et Coulomb montrent que les fluides électriques déposés dans un corps conducteur se portent toujours à la surface, ce qui correspond bien à ce qu’on attend de charges mobiles obéissant à la loi de Coulomb.
A partir du concept de potentiel, introduit par le français Joseph Louis Lagrange pour la gravitation, ses compatriotes Pierre Simon de Laplace et Siméon Denis Poisson, puis l’anglais George Green (1793 – 1841) et l’allemand Karl Friedrich Gauss (1777 – 1855), développent une formulation mathématique de l’électrostatique qui sera transposée aux phénomènes magnétiques en tenant compte du fait qu’à la différence des charges électriques, les charges magnétiques ne peuvent être isolées et ne sont pas mobiles : tout aimant, si petit soit-il, a deux pôles – Nord et Sud – qui portent des charges magnétiques opposées. Coulomb établit également qu’il existe pour les charges magnétiques une loi de l’inverse carré analogue à celle qui concerne les charges électriques ; il imagine en outre une théorie moléculaire du magnétisme.
Seuls des courants électriques transitoires pouvaient alors être produits – le temps que se déchargent les bouteilles de Leyde. Louis-Guillaume Le Monnier (1717 – 1799), qui observe ce phénomène en 1746, en déduit que la vitesse d’écoulement est beaucoup plus grande que celle du son. De même, les chercheurs remarquent la similitude entre les décharges électriques des poissons-torpilles et celles des bouteilles de Leyde. En 1791, l’italien Luigi Galvani (1737 – 1798) découvre qu’un muscle de grenouille peut être excité par le contact du nerf avec un objet métallique. L’effet est encore plus marqué avec deux métaux. On imagine alors une électricité animale – il faut dire qu’à l’époque, les savants observent toutes sortes de « fluides » (électrique, magnétique, calorique, gazeux, …), parfois difficiles à différencier. Alors pourquoi pas un fluide d’électricité animale ? C’est un autre italien, Alessandro Volta (1745 – 1827), qui éclaircit la question en inventant la pile électrique, première source connue de courant continu, en 1800.
Le XIXème siècle verra la naissance de l’électrodynamique et de l’électromagnétisme, impliquant des physiciens tous plus prestigieux les uns que les autres : entre autres, Maxwell et Faraday imprimeront le siècle de façon particulièrement remarquable.
En savoir plus : http://www.ampere.cnrs.fr/parcourspedagogique/zoom/18e/index.php
L’astronomie
La publication, en 1687, de la théorie de la gravitation universelle de Newton donne à la mécanique céleste ses fondements théoriques. Les lois du mouvement des astres sont désormais connues, maîtrisées. Les mystères semblent avoir disparu, et une nouvelle ère commence. Toutefois, pour établir avec précision les mouvements des astres mobiles, il faut disposer de positions stellaires précises. En élaborant ses cartes de positions d’étoiles, Edmund Halley découvre, en 1718, que certaines étoiles se déplacent sur le fond du ciel, et qu’elles possèdent un mouvement propre. Une amélioration de la précision des cartes célestes et des catalogues devient alors indispensable. L’anglais John Flamsteed (1646 − 1719), premier directeur de l’Observatoire de Greenwich, réalise le premier catalogue astrométrique de positions d’étoiles.
Les nouvelles possibilités de calcul et la précision des mesures de l’époque permettent de faire progresser rapidement la connaissance de l’environnement terrestre. Etudiant la Lune et les éclipses anciennes, Halley découvre le ralentissement de la Terre, confortant les tenants newtonien d’une Terre aplatie aux pôles à cause de la fluidité du magma intérieur. Les éclipses commencent à être exploitées pour donner des résultats scientifiques concernant la taille de la Lune, sa position exacte et l’existence de son atmosphère.
Concernant les comètes, comme on ne connaît alors rien de leur nature, si ce n’est qu’elles sont massives et qu’elles subissent donc l’attraction du Soleil, les spéculations catastrophistes vont bon train. Le suisse Jacques Bernoulli (1654 – 1705) calcule avec une précision toute astronomique la fin du monde par collision cométaire pour le 17 mai 1719, annonçant au préalable que, dans les comètes, les queues doivent être plus dangereuses que les têtes ! Halley publie en 1705 la prévision du retour de la comète de 1682 pour 1759. Dès 1756, les astronomes scrutent le ciel à la recherche de l’astre attendu. Le français Charles Messier (1730 – 1817) commence l’édification d’un catalogue des objets diffus, accessibles à ses instruments et susceptibles d’être confondus avec une comète. Ce catalogue, qui contient cent huit objets distincts et disparates (amas stellaires, nébuleuses et galaxies), reste utilisé aujourd’hui.
 |
La comète de Halley fut observée 240 ans avant notre ère, et elle a accompli depuis 29 retours vers le Soleil. On trouve en particulier sa trace sur la tapisserie de Bayeux pour son passage en 1066. "istimirant stella" : ils observent l'étoile. Harold est l'un des prétendants à la couronne d'Angleterre à la succession d'Edouard ; Guillaume, l'autre prétendant, sera victorieux à Hastings la même année et deviendra le célèbre Guillaume le Conquérant que l'Histoire a retenu : la comète aura été un funeste présage pour Harold... |
Le calcul de la date du retour de la comète de Halley au plus près du Soleil va donner ses lettres de noblesse à la mécanique céleste. A Paris, Alexis Claude Clairaut (1713 – 1765), Jérôme Lalande (1732 – 1807) et Nicole-Reine Lepaute (1723 – 1788), au prix de calculs acharnés, mettent en évidence un léger retard pour le retour de la comète, qui est espéré pour le 15 avril 1759. Retrouvée par l’allemand Johann Palitsch (1723 – 1788), près de Dresde, le 23 décembre 1758, la comète confirme la puissance de l’investigation scientifique et la maîtrise des calculs de mécanique céleste.
Ce domaine va se développer sous l’impulsion de grands mathématiciens astronomes comme les français Alexis Clairaut et Jean Le Rond d’Alembert (1717 – 1783), et le suisse Leonhard Euler (1707 – 1783), qui résolvent, simultanément et indépendamment, le problème des trois corps – le mouvement de deux petits corps en interaction gravitationnelle placés dans le champ de gravitation d’un gros corps (par exemple, la Terre et la Lune en interaction dans le champ gravitationnel du Soleil). Ils ouvrent ainsi la voie aux éphémérides de grande précision, en particulier dans le cas du système Terre-Lune.
Les astronomes utilisent leurs techniques d’observation et d’analyse pour améliorer la connaissance de la Terre. En 1735, l’Académie des Sciences organise deux expéditions pour déterminer la forme du Globe : Pierre Bouguer (1698 – 1758), Charles de La Condamine (1701 – 1774), Joseph de Jussieu (1704 – 1779) et Louis Godin (1704 – 1760) purent mesurer avec la plus grande précision possible la longueur du degré de méridien près de l’équateur, tandis que Pierre Louis Moreau de Maupertuis (1698 – 1759), Alexis Clairaut et Pierre Charles Le Monnier (1715 – 1799) vont effectuer la même opération en Laponie. La confrontation des mesures des deux équipes montre que la Terre est aplatie aux pôles et renflée à l’équateur, comme le pensait Newton, et contrairement aux idées de Jacques Cassini. Entre 1792 et 1799, des mesures précises seront menées sur le méridien de Paris par Pierre Méchain (1744 – 1804) et Jean-Baptiste Delambre (1749 – 1822) pour en tirer la valeur de l’étalon de longueur, le mètre, dix-millionième partie du quart du méridien terrestre.

L’amélioration des modèles mathématiques décrivant les mouvements de la Lune est à porter au crédit de quelques grands noms de l’histoire de l’astronomie. Outre Edmund Halley, auteur d’une impressionnante quantité d’observations de très grande qualité, l’allemand Tobias Mayer (1723 – 1762) donne une explication géométrique des librations, ces mouvements d’oscillation de la Lune qui permettent d’en scruter, depuis les observations terrestres, un peu plus de la moitié ; il publie aussi la carte lunaire la plus précise de son époque. En France, Joseph Louis Lagrange (1736 – 1813) reçoit en 1764 un prix de l’Académie des sciences pour son travail sur le problème de la libration de la Lune. Pierre Simon de Laplace (1749 – 1827), illustre mathématicien et astronome, donne une méthode générale permettant de traiter les problèmes de dynamique et publie une Mécanique céleste en cinq volumes entre 1799 et 1825, ainsi qu’un remarquable ouvrage de vulgarisation scientifique, Exposition du système du monde. Ses calculs montrent que la durée du mois lunaire doit diminuer de 0,077 seconde par siècle, ce qui correspond à l’accélération mise en évidence par Halley dans son étude des éclipses anciennes.
Quelques mathématiciens contribuent ensuite au progrès de la théorie de la Lune : les français Siméon Denis Poisson (1781 – 1840), surtout connu pour ses travaux de statistique, et Philippe Gustave Doulcet de Pontécoulant (1795 – 1874), qui publie en 1846 une théorie analytique du monde, puis l’allemand d’origine danoise Peter Andreas Hansen (1795 – 1874), et enfin Charles Delaunay (1816 – 1872) qui, reprenant une idée d’Emmanuel Kant, propose en 1865 d’expliquer l’accélération séculaire de la Lune par un ralentissement de la rotation de la Terre dû à des effets de marée.
Les observations stellaires progressent grâce aux nouveaux moyens d’observation liés aux améliorations apportées aux lunettes. Celles-ci, suite aux travaux d’Auzout et de Huygens, sont désormais équipées d’oculaires munis d’un réticule (croisée de fils très fins permettant des visées plus précises). Dès les années 1660, l’anglais James Gregory (1638 – 1675) a tenté d’améliorer la qualité des images obtenues en remplaçant, dans les instruments d’observation, des lentilles par des combinaisons de deux miroirs, respectivement parabolique et elliptique, autrement dit en substituant le télescope réflecteur à la lunette astronomique (réfracteur). C’est toutefois Newton qui est parvenu à fabriquer, en 1668, le premier télescope, composé d’un miroir plan et d’un miroir parabolique – mais la présentation d’en a été faite qu’en 1671. L’année suivante, le français Laurent Cassegrain (1652 – 1712) proposait à son tour un télescope, fondé sur une autre combinaison de miroirs et dans lequel l’image se forme à l’arrière du miroir principal, à travers un trou percé au centre.
Au début du XVIIIème siècle, les télescopes ne sont pas encore réellement utilisables, mais suscitent de plus en plus d’intérêt de la part des observateurs. L’anglais John Hadley (1682 – 1744) réussit à construire, à l’Observatoire de Greenwich, le premier réflecteur égalant en puissance les meilleures lunettes de l’époque. Cependant, la lunette bénéficie d’une importante amélioration : en 1733, l’anglais Chester Moor Hall (1703 – 1771) construit le premier objectif achromatique, associant deux lentilles en verres différents : l’une, convergente, en verre de Venise (crown), et l’autre, divergente, moins puissante que la précédente, de façon que l’ensemble reste convergent, mais taillée dans un verre plus dispersif (flint). Largement diffusées à partir de 1758 par l’opticien britannique John Dollond (1706 – 1761), les lunettes achromatiques fournissent des images de bien meilleure qualité que celles à simple lentille utilisées jusqu’alors, tout en étant, à puissance égale, beaucoup moins encombrantes.

Avec ces instruments perfectionnés, les mesures se font plus précises. Halley avait proposé d’observer avec précision les étoiles à fort mouvement propre, cette particularité étant à ses yeux un indice de proximité. En chercher à mesurer la parallaxe de l’étoile γ du Dragon, Eltamin, le britannique James Bradley (1693 – 1762), troisième astronome royal, met en évidence l’aberration de la lumière des étoiles. Il s’agit d’une conséquence de la vitesse finie de la lumière qui, combinée à la vitesse orbitale de la Terre, provoque un déplacement annuel des étoiles. La preuve expérimentale du mouvement de la Terre est ainsi établie en 1728.
Forts de la découverte de mondes nouveaux et des progrès considérables de l’observation céleste, les astronomes commencent à élaborer des théories de l’Univers réellement nouvelles. De nombreuses nébuleuses sont découvertes et l’interrogation sur leur nature provoque des explications étonnantes. Pour le britannique William Denham (1657 – 1735), il s’agit d’accrocs dans le firmament laissant voir la lumière du paradis. Le français Jean Henri Lambert (1728 – 1777) propose un univers fini et explique que la Voie Lactée n’est qu’une observation des étoiles réparties dans une structure en forme de disque. Le britannique Thomas Wright (1711 – 1786) tente de concilier science et religion en faisant tourner le Soleil et les étoiles autour du « divin centre ». L’allemand Emmanuel Kant (1724 – 1804) imagine dès 1754 l’existence d’un univers-îles : l’Univers serait peuplé de systèmes analogues à la Voie Lactée, rassemblant chacun une énorme quantité d’étoiles.
En 1761 et 1769, les astronomes vont utiliser les deux passages de Vénus devant le Soleil pour tenter d’améliorer la connaissance de la distance Terre-Soleil. Des expéditions sont organisées dans l’océan Indien, en Sibérie, en Inde, à Sainte-Hélène, au cap de Bonne-Espérance, en Norvège pour le passage de 1761. Celui de 1769 occupe un nombre encore plus grand de savants, partis pour Saint-Domingue, Tahiti, la baie d’Hudson, la Sibérie et l’Inde. Les résultats ne seront malheureusement guère probants et ne modifieront pas sérieusement la valeur admise alors pour cette distance. Pour affiner sensiblement cette valeur, il faudra attendre le XXème siècle et les passages au plus près de la Terre de l’astéroïde 433 Eros, découvert en 1898.
Parallèlement au développement spectaculaire de la mécanique céleste, on assiste au XVIIIème siècle aux débuts de l’astronomie stellaire. William Herschel (1738 – 1822), musicien d’origine allemande établi en Angleterre, très attiré par l’astronomie, se lance à partir de 1774 dans la construction de télescopes à l’aide desquels il effectue, en amateur, de très nombreuses observations astronomiques de grande qualité. Il entreprend les premières recherches systématiques d’étoiles doubles et de nébuleuses, et donne naissance à la statistique stellaire. Le 13 mars 1781, la qualité du télescope de 15 cm d’ouverture qu’il utilise alors lui permet de distinguer un astre d’aspect non stellaire qu’il prend d’abord pour une comète. Mais les calculs d’orbite montrent que cette comète est très éloignée et qu’elle tourne autour du Soleil sur une orbite presque circulaire, deux fois plus loin du Soleil que Saturne. Il s’agit en fait d’une nouvelle planète, qui sera nommée Uranus. Devenu célèbre et honoré par le roi d’Angleterre Georges III, Herschel se consacre totalement à l’astronomie. Il établit le premier modèle tridimensionnel de l’Univers en 1784, publie son premier catalogue de 1 000 nébuleuses en 1786, et découvre deux satellites autour de la nouvelle planète qu’il a identifiée, Titania et Obéron, en 1787, puis deux satellites de Saturne, Encelade et Mimas, en 1789.

The Great-Forty Foot telescope de W.
Herschel construit de 1785 à 1789.
Le miroir primaire fait 120 cm de diamètre (ce miroir existe toujours) ; la
focale est de 12 m (40 pieds).
L'instrument pourrait avoir permis la découverte d'Encelade et de Mimas.
Les instruments deviennent de plus en plus gigantesques. Le record atteint par Herschel est un réflecteur de 1,2 m de diamètre et de 12 m de longueur focale, construit en 1786, qui restera le plus grand télescope du monde pendant un demi-siècle. Aidé dans ses observations par sa sœur Caroline Lucretia Herschel (1750 – 1848), il publie deux nouveaux catalogues en 1789 et en 1802, tandis que Caroline découvre huit comètes. A la même époque, le britannique John Goodricke (1764 – 1786) explique la variation de la célèbre étoile Algol, la tête de la Méduse, dans la constellation de Persée, par la présence d’une étoile compagnon qu’aucun instrument n’arrivera à séparer de la composante principale avec la fin du XXème siècle.
C’est aussi au cours du XVIIIème siècle que le problème de la mesure des différentes longitudes est résolu. Mais ce sont les horlogers qui viennent au secours des astronomes, en réalisant des garde-temps fiables et précis. Le britannique John Harrison (1693 – 1776) réussit à construire le premier chronomètre de marine en 1735. L’Observatoire de Greenwich devient la référence temporelle mondiale, détrônant celui de Paris. L’officialisation de ce choix de sera réalisée qu’en 1884, lors de la Conférence internationale sur le méridien ; la France attendra toutefois 1911 pour délaisser le méridien de Paris et se rallier au méridien de Greenwich, devenu le méridien origine des longitudes.
 |
  |
| Harrison H1 (1735) : le premier modèle à pouvoir être embarqué. | Harrison H4 (1761) :
un montre de poche Partie d'Angleterre le 18 novembre 1761, elle arriva en Jamaïque le 19 janvier 1762 en accusant 5,1 secondes de perte. Insuffisant pour le bureau de l'Act of Longitude, qui ne dut se résoudre à lui admettre la récompense qu'après l'intervention du roi George III ! |
A la fin du XVIIIème siècle, avec l’étude attentive des orbites planétaires et la connaissance accrue des caractéristiques des corps tournant autour du Soleil, revient à l’esprit des astronomes une remarque de Kepler : il semble y avoir une rupture entre les planètes proches du Soleil, jusqu’à Mars, et les deux planètes extérieures connues à l’époque, Jupiter et Saturne. Non seulement les deux dernières sont plus volumineuses que les autres, mais elles sont beaucoup plus éloignées du Soleil, comme si un fossé séparait deux zones très différentes du système solaire. Dès 1766, l’allemand Johann Daniel Tietz, dit Titius (1729 – 1796), propose une loi empirique reliant l’éloignement des planètes par rapport au Soleil à leur rang. Son compatriote Johann Elter Bode (1747 – 1826) la reformule et la publie en 1772. La découverte d’Uranus, en 1781, vient la conforter : la nouvelle planète, de rang 8, décrit une orbite dont le demi-grand axe est proche de ce que prévoit la loi de Titius-Bode. Or, celle-ci suggère la présence d’une planète entre Mars et Jupiter… qui se révèlera être, en fait, le spectre de la ceinture d’astéroïdes !
Les astronomes s’organisent donc pour trouver cette planète inconnue. Sous l’impulsion d’un astronome autrichien, le baron Franz Xaver von Zach (1754 – 1832), les allemands créent la Vereinigte Astronomische Gesellschaft à l’automne 1800 et commencent à publier le premier périodique scientifique professionnel, Monalitliche Correspondenz. Celui-ci sera suivi, à partir de 1823, par le premier périodique entièrement astronomique Astronomische Nachrichten. Zach met en place une réelle collaboration internationale pour l’élaboration de cartes précises du zodiaque, outils indispensables permettant de débusquer un astre mobile se déplaçant lentement dans cette zone du ciel.
La
chimie
Fervent adepte de la balance,
Nicolas Lémery (1645 - 1715) est considéré comme le chimiste cartésien par
excellence. Pourtant, s'il applique la méthode de Descartes à la chimie, il ne
fait jamais référence à la pensée du philosophe sur la matière, pas plus qu'il
ne se rallie aux idées atomistes de
Gassendi (1592 - 1655). C'est avant un
pragmatiste.
D'origine rouennaise, il est l'élève de Christophe
Glaser avant d'aller étudier
la pharmacie à Montpellier, où la faculté de médecine est acquise à
l'iatrochimie (médecine chimique), contrairement à son homologue parisienne.
Lémery s'y initie à l'enseignement. De retour à Paris en 1672, il devient deux
ans plus tard apothicaire privilégié suivant la Cour. Rue Galande, il ouvre un
cours public de renom. La première édition de son Cours de Chymie
paraîtra en 1675.
Après un bref exil en Angleterre suite aux mesures antiprotestantes,
Lémery revient en France et, en 1684, obtient le titre de docteur en médecine. Après la
révocation de l'Edit de Nantes, en 1685, il abjure la religion réformée et
obtient le privilège exceptionnel d'exercer à la fois les fonctions
d'apothicaire et celles de médecin. Sa Pharmacopée universelle paraît en
1697, et l'année suivante, son Traité des drogues simples. En 1699, il
est nommé associé-chymiste à l'Académie royale des sciences, dont il devient
pensionnaire. Le Traité de l'antimoine est publié en 1707.
Lémery mourra
en 1715, tout comme Louis XIV.
Son souci de clarté est évident. Il s'appuie sur l'expérience, et se méfie de la
théorie. Mais son cartésianisme le gêne lorsqu'il doit aborder l'énoncé des
principes de chimie. Il admet, comme à regret, l'existence d'un "principe
universel" : "Le premier principe qu'on peut admettre pour la composition des
Mixtes, est un esprit universel, qui étant répandu par tout, produit diverses
choses selon les diverses Matrices ou Pores de la terre dans lesquels il se
trouve embarrassé." Ce qu'il nuance aussitôt : "Mais comme ce Principe
est un peu Métaphysique, & qu'il ne tombe point sous le sens, il est bon d'en
établir de sensibles c'est pourquoy je rapporteray ceux dont on se sert
communément."
Il énumère alors, sans enthousiasme, les cinq principes que l'on trouve déjà
chez Le Febvre ou Glaser, principes néanmoins susceptibles d'être remis en cause
par l'évolution des connaissances : "Comme les Chymistes en faisant l'analyse
de divers Mixtes, ont trouvé cinq sortes de substances, ils ont conclu qu'il y
avoit cinq Principes des choses naturelles, l'Eau, l'Esprit, l'Huile, le Sel &
la Terre. De ces cinq, il y en a trois Actifs, l'Esprit, l'Huile & le Sel, &
deux Passifs, l'Eau et la Terre. Il les ont appelez Actifs, parce qu'estant dans
un grand mouvement, ils font toute l'action du Mixte, ils ont nommé les autres
Passifs, parce qu'estant au repos, ils ne servent qu'à arrêter la vivacité des
Actifs."
Mais le ton change lorsque
Lémery aborde la distinction, essentielle, entre les
acides, pourvus de pointes, et les alcalis, caractérisés par la présence de
pores. La réaction de neutralisation se produit à ses yeux lorsque les pointes
des acides pénètrent dans les pores des alcalis. C'est la conception mécaniste
de la réaction chimique qui est véritablement originale, puisque
Libavius
évoquait déjà les pointes des acides et que
Descartes considérait que "tous
les corps terrestres ont bien des pores".
Ce modèle d'accouplement entre les acides et les alcalis lui permet de
comprendre l'aspect quantitatif de la neutralisation, la différence entre le
"sel salé", produit par la réaction, et un simple mélange d'acide et d'alcali,
et même de pressentir l'existence de substances amphotères - ayant le
comportement des acides ou des bases selon le milieu dans lequel elles se
trouvent.
Dans un tout autre domaine - la définition de "l'esprit qu'on appelle mercure"
-, Lémery est le premier à opposer la chimie des minéraux imputrescibles à celle
des végétaux et des animaux, soumis à la corruption. On peut lire ici la
première distinction entre chimie minérale et chimie organique.
En dépit
du caractère dominant des références aristotéliciennes, un courant de pensée
reposant sur l'existence de particules persiste, courant qu'illustre Robert
Boyle (1627-1691) et auquel se rattache plus ou moins Nicolas
Lémery, dont l'interprétation
de la réaction acide-base présente, on l'a vu, des aspects mécanistes et
corpusculaires.
L'atomisme lui-même n'a pas absolument disparu. En 1624, quatorze thèses de Jean
Bitaud, Antoine de Villon et Etienne de Clave, contestant les doctrines
d'Aristote, de Paracelse et de la Kabbale sont condamnées par le Parlement. On
peut également retenir la théorie de la matière de
Descartes qui, s'il refuse
l'atomisme et le vide, admet des "parties" de matière (Principes de la
philosophie, 1647), et surtout les conceptions physiques de Pierre
Gassendi,
très proche du modèle épicurien (Animadversiones, 1649). Le professeur de
médecine Daniel Sennert (1572-1637) est quant à lui tellement convaincu de
l'existence des atomes qu'il tente de déterminer la taille des atomes d'alcool
en faisant passer des vapeurs de ce corps à travers les pores d'une feuille de
papier pliée en quatre. Joachim
Jung (1587-1657) se réfère également à
l'atomisme et parle d'appétit des corps les uns pour les autres, ce qui aboutira
à la notion d'affinité. Mais il faudra toutefois attendre Newton pour que des
bases plus modernes soient données à l'atomisme.
Le cas de
Newton (1642-1727) est particulier : en particulier, il pratique
secrètement l'alchimie, tout en faisant référence à l'atomisme. Il remplace
l'interprétation des atomes crochus de Lutèce par la notion d'attraction : "Pour
moi, j'aime mieux conclurre (sic) de la cohesion des Corps, que leurs particules
s'attirent mutuellement par une Force qui dans le contact immédiat est
extremement puissante ; qui à des petites distances produit les Opérations
chimiques [...] ; & qui à de fort grandes distances des particules des corps
n'agit point, du moins par des effets sensibles" (Traité d'optique,
Amsterdam, 1720).
Malgré tout, l'atomisme demeure, au XVIIème siècle, un courant secondaire, et
n'inspire pas les grandes réflexions qui vont agiter le monde de la chimie au
siècle suivant.
Le pragmatisme du siècle de Descartes s'est avéré nécessaire : après la Renaissance, la chimie devait se recentrer sur l'expérience, entraînant un certain recul des spéculations théoriques. Le XVIIIème siècle va en revanche se montrer riche de théories. A la hiérarchie des affinités, établie par Geoffroy, succédera le phlogistique de Stahl et de ses continuateurs. Le siècle se termine en apothéose avec la révolution chimique provoquée par la théorie de l'oxydation de Lavoisier.
Geoffroy
et la table des affinités
Avant d'être médecin, Etienne-François
Geoffroy (1672-1731) est maître
apothicaire, ce qui l'amène à s'intéresser à la chimie. En 1718, il publie une
Table des affinités permettant de prévoir les combinaisons entre les corps
chimiques et de déterminer le sens du déplacement d'une substance par une autre
au sein de combinaisons.
L'aversion de la science officielle pour les affinités contraint
Geoffroy à
préférer au terme d'affinités celui de rapports : "On observe en chimie
certains rapports entre différents corps, qui font qu'ils s'unissent aisément
les uns aux autres [...] parmi plusieurs matières confondues et qui ont
quelque disposition à s'unir ensemble, on s'aperçoit qu'une de ces substances
s'unit toujours constamment avec une certaine autre, préférablement à toutes."
Approfondissant son raisonnement,
Geoffroy établit une loi fondamentale de la
chimie : "Toutes les fois que deux substances ont quelque disposition à se
joindre l'une avec l'autre se trouvent unies ensemble, s'il en survient une
troisième qui ait plus de rapport avec l'une des deux, elle s'y unit en faisant
lâcher prise à l'autre." C'est sur ces principes que repose sa fameuse
table. Dans des colonnes verticales sont rangés, par ordre d'affinité
décroissante, des corps susceptibles de se lier à celui représenté sur la ligne
horizontale supérieure du tableau. On peut par exemple observer que des esprits
acides ont en général plus d'affinité pour un sel alcali fixe que pour le sel
alcali volatil, ce qui signifie en langage moderne qu'un acide réagit mieux avec
une base forte qu'avec l'ammoniaque : on peut donc déplacer l'ammoniaque de ses
sels par des bases fortes.
Cette table, fondée sur un principe rigoureux et sur une compilation
d'expériences, constitue la première tentative rationnelle pour prévoir
l'évolution d'une réaction chimique et classer des réactifs par leur capacité
réactionnelle. Ses contemporains reconnaissent rapidement sa valeur : elle
marque en effet une étape cruciale de l'histoire de la chimie.
La
théorie du phlogistique
Les trois premiers quarts du XVIIIème siècle sont dominés par la théorie du
phlogistique, que Pierre Joseph
Macquer qualifie de "sublime" dans son
Dictionnaire de Chymie (1776).
A l'origine se trouve Johann Joachim
Becher (1635-1682), médecin allemand proche
des alchimistes, qui considère la terre comme l'un des éléments aristotéliciens.
Dans sa Physica subterranea (1669), il distingue trois sorte de terres :
la terre vitrifiable, que l'on trouve dans le cristal de roche, la terre
mercurielle, censée entrer dans la composition des métaux, et la terre
inflammable, dont son compatriote
Stahl fera le phlogistique.
Georg Ernst
Stahl (1660-1734), lui aussi médecin, reprend la
Physica
subterranea de Becher en lui adjoignant ses propres réflexions sous le titre
de Specimen Beccherianum, en 1702. Son œuvre la plus importante, le Traité du soufre, est publiée en allemand en 1717, et en français en 1766.
Dans sa théorie, les corps inflammables sont caractérisés par la présence d'une
substance inflammable, le phlogistique, du grec
jlox
signifiant flamme. En brûlant, le corps inflammable est censé perdre ce principe
igné, qui se dégage sous forme de flamme, ne laissant plus qu'un "corps
déphlogistiqué", qui n'est plus combustible, une chaux.
Ce système cohérent permet d'interpréter de façon logique de nombreuses
réactions : le transformation inverse d'une chaux en métal s'explique par
exemple par la fixation de phlogistique par la chaux.
Cette théorie, qui embrassait toute la chimie, connut dans toute l'Europe un
succès extraordinaire. En Allemagne, cette pensée est notamment diffusée par
Caspar Neumann (1683-1737) et Johann Heinrich Pott (1692-1777), qui enseignaient
à Berlin. En France, elle est surtout diffusée par Guillaume François
Rouelle
(1703-1770), apothicaire du Roi et démonstrateur de chimie au Jardin du Roi, qui
y introduit une nuance importante, et non dénuée de pertinence : pour lui, le
phlogistique est le "feu élémentaire" et non plus une "terre inflammable". Des
philosophes tels que Diderot vinrent écouter ce conférencier remarquable, ainsi
que de nombreux chimistes -
Lavoisier,
Bayen ou
Bucquet -, qui s'illustrèrent
plus tard dans la lutte contre le phlogistique. Son élève Pierre Joseph
Macquer
(1718-1784) resta quant à lui fidèle à cette théorie, dont son célèbre
Dictionnaire de chymie, publié en 1766, est la meilleure présentation.
Jacques François
Demachy (1728-1803), ancien apothicaire gagnant-maîtrise de
l'Hôtel-Dieu de Paris, contribua à la diffusion des idées de
Stahl en publiant,
en 1758, les Eléméns de chymie suivant les principes de Becker (sic) et de
Stahl, traduction d'un volumineux ouvrage de Johann Junker paru en latin en
1730.
Souvent présenté comme un tenant de la théorie du phlogistique, le hollandais
Hermann Boerhaave (1668-1738) publie en 1732 les Elementa Chemia, où il recense
les connaissances de son temps et exprime quelques réserves quant à certains
aspects de la théorie du phlogistique. Il doute notamment que les combustibles
puissent se changer en "feu élémentaire" en brûlant, car "si cela étoit ainsi,
il faudroit enfin que l'élément du feu s'augmentât à l'infini".
Et si la théorie du phlogistique, logique et générale, stimula la recherche en
chimie, elle permit également le développement d'une autre recherche : la chimie
pneumatique.
Les conditions sont enfin réunies pour le développement de la chimie dite
pneumatique : Van Helmont a découvert les gaz, Robert
Boyle les a étudiés, et
Stephen Hales a inventé la fameuse cuve à eau permettant des études
quantitatives. A cause des lenteurs de publication, il n'est pas toujours facile
d'identifier les auteurs des découvertes. Une vraie rivalité oppose alors
chimistes britanniques, suédois et français.
Joseph Black et l'air fixe
Né à Bordeaux, c'est en Ecosse que Joseph
Black (1728-1799) fait sa carrière.
Savant et homme du monde, excellent enseignant, il consacre toute sa vie à
l'étude.
A côté de ses découvertes importantes dans le domaine de la physique, comme la
chaleur latente et la chaleur spécifique,
Black marque l'histoire de la chimie
en identifiant de façon rigoureuse l'air "fixe" (notre gaz carbonique), déjà
observé par Van Helmont. Il montre que ce gaz est différent de l'air
atmosphérique, et qu'il est produit aussi bien par la respiration que par la
calcination de substances minérales, qu'il appelait des terres alcalines (nos
carbonates). Il prouve également qu'une atmosphère d'air "fixe" ne permet pas
aux être vivants de respirer.
Malgré la rigueur de sa démonstration, les travaux de
Black provoquent des
réactions contrastées dans les milieux scientifiques. Une polémique oppose ainsi
ses partisans à ceux de Johann Frederich Meyer. Cet apothicaire d'Osnabrück a en effet
publié en 1764 un ouvrage traduit en français deux ans plus tard, sous le titre
d'Essais sur la chimie de la chaux vive, la matière élastique et électrique, le
feu et l'acide universel
[ö]. Il y développe une étrange théorie fondée sur la
notion d'acidum pingue.
Pour Meyer, lors de la combustion d'une pierre calcaire (CaCO3), il y a gain
d'un acide, ce fameux acidum pingue, responsable de l'apparition de la
causticité du produit obtenu (la chaux vive, CaO). En revanche, lorsque la chaux
vive réagit avec un alcali fixe (comme le carbonate de potassium, K2CO3), elle
se trouble et cède son acidum pingue à l'alcali, ce qui est censé faire cesser
la causticité, mais aussi pouvoir provoquer l'effervescence. Comme le
phlogistique, l'acidum pingue doit avoir un poids négatif !
Malgré son caractère ambigu, cette théorie trouve rapidement d'ardents
défenseurs : Lavoisier lui-même écrit "qu'il est peu de livres de chimie moderne
qui annoncent plus de génie que celui de Meyer".
Mais la supériorité de la théorie de
Black finit par triompher. Longtemps
partisan de la théorie du phlogistique, malgré sa correspondance avec
Lavoisier,
Black se convertit à la doctrine de l'oxydation avant sa mort.
Henry
Cavendish et la constitution de l'eau
Appartenant à l'aristocratie britannique, Henry
Cavendish (1731-1810) put
consacrer sa vie à l'étude ; ses travaux se situent résolument dans le domaine
de la chimie pneumatique. En traitant le fer et le zinc par un acide, il obtient
de "l'air inflammable" (notre dihydrogène). Il s'intéresse à l'air "fixe" de
Black (notre gaz carbonique), dont il étudie la capacité à se fixer sur les
alcalis. A l'aide d'un appareil dans lequel les gaz sont contenus par un joint
de mercure, il évalue la composition de l'air. Son œuvre essentielle reste
toutefois la synthèse de l'eau, que
Lavoisier saura interpréter.
Joseph Priestley et l'oxygène
Né à Fieldhead, dans le Yorkshire, Joseph
Priestley (1733-1804) devient pasteur,
fonde une école, et est amené à s'intéresser à la physique. Encouragé par
Franklin, il publie en 1767 une Histoire et état présent de
l'électricité, qui lui permet d'accéder à la Royal Society de Londres. Son
activité se partage dès lors entre recherche scientifique et quête théologique.
Ses sympathies pour la Révolution française lui vaudront la vive hostilité de la
population britannique : sa maison est brûlée par des manifestants. Il se
réfugiera en Amérique en 1794, où il mourra dix ans plus tard.
Priestley est toujours resté convaincu du bien-fondé de la théorie du
phlogistique, que l'ensemble de ses travaux tentent de démontrer. Publiées en
1772, ses Observations on different kinds of air marquent son entrée sans la
chimie pneumatique.
Si ses premiers travaux sur l'air "fixe" (notre gaz carbonique) n'apportent
guère plus que ceux de Black, il découvre un point important : le comportement
des plantes vis-à-vis de l'air "fixe" est différent de celui des animaux.
Fondant la physiologie végétale, il montre que les plantes prospèrent au sein
d'une atmosphère d'air "fixe" et qu'à la lumière, elles sont capables de
transformer cette atmosphère en un milieu propice à la vie des animaux. Il ne
peut cependant interpréter plus avant le mécanisme de la photosynthèse.
Pour réaliser ses travaux de chimie pneumatique,
Priestley est amené à apporter
une modification importante à la cuve de
Hales, dont il remplace l'eau par du
mercure. L'intérêt de cette cuve à mercure, c'est que les gaz, susceptibles de
se dissoudre dans l'eau, sont beaucoup moins solubles dans le mercure, ce qui
permet des mesures de volume beaucoup plus précises. Dans ces conditions,
Priestley parvient à faire des découvertes intéressantes dans le domaine de ce
que nous appelons les oxydes d'azote. En traitant du cuivre par de l'eau forte
(acide nitrique), il obtient un gaz qu'il nomme l'air "nitreux". Il constate
également que ce gaz prend une teinte rougeâtre intense au contact de l'air
atmosphérique. Il remarque également qu'au cours de cette transformation, un
cinquième de l'air "ordinaire" est consommé : ainsi se trouve-t-il déjà sur la
voie de la découverte de l'oxygène, d'autant qu'il a observé qu'un air dans
lequel on a respiré réagit avec une quantité d'air "nitreux" plus faible que
l'air frais.
Priestley passe à nouveau très près de l'identification de l'oxygène en 1772,
lorsqu'il constate que la combustion du charbon consomme également le cinquième
de l'air et produit de l'air "fixe", qui peut être piégé sur de la chaux. Il
remarque même alors que cette opération laisse un gaz inerte, qu'il nommera plus
tard air "phlogistiqué" (notre azote).
En 1774,
Priestley chauffe à l'aide d'une lentille du "mercure calciné per se"
(oxyde rouge de mercure) et isole un gaz susceptible d'entretenir la combustion
avec une vigueur remarquable. Méfiant quant à la qualité de son "mercure
calciné", il attend de se rendre à Paris pour faire l'acquisition d'une matière
première d'excellente qualité. A l'occasion de ce voyage, il rencontre
Lavoisier
et lui fait part de l'avancement de ses travaux. Dès son retour en Angleterre,
il réitère son expérience avec le "mercure calciné" parisien : il a identifié un
nouveau gaz, constituant de l'air, qu'il nomme "air déphlogistiqué" et dont il
décrit les propriétés.
Priestley a découvert l'oxygène. Il a aussi su fabriquer et décrire l'air "de
l'esprit de sel" (notre acide chlorhydrique), l'air "alcalin" (notre ammoniac)
et l'air "vitriolique" (notre dioxyde de soufre). Malheureusement,
l'exploitation des résultats nés de ce travail remarquable a été entravée par
son attachement à la théorie du phlogistique, et c'est
Lavoisier qui donnera à
ses découvertes une interprétation théorique.
Carl Wilhelm Scheele, chercheur brillant et méconnu
Il est rare de rencontrer des chercheurs discrets au point de ne pas se soucier
de diffuser leurs résultats, surtout s'ils sont fondamentaux : tel est pourtant
le cas du chimistes suédois Scheele (1742-1786). Né à Straslund, il se passionne
très tôt pour la chimie. Les Praelectiones chymicae de Caspar Neumann
deviennent son livre de chevet. A Uppsala, il rencontre le chimiste Torbern
Bergmann (1735-1784), théoricien des affinités qui l'encourage, sans parvenir à
le convaincre, à accepter un poste officiel.
Scheele choisit au contraire de se
rendre à Kjoping, petite ville suédoise, où il s'occupe, à la demande de la
veuve, d'une officine dont le titulaire vient de mourir, consacrant à ses
recherches chimiques la plus grande partie de ses maigres gains. Sentant la mort
venir, il aurait - dit-on - épousé la veuve pour la mettre à l'abri du besoin.
Il meurt deux jours après la cérémonie, le 21 mai 1786.
Scheele travaille toujours seul, avec un matériel peu coûteux : les gaz sont par
exemple recueillis dans de simples vessies de porc. Il effectue néanmoins des
découvertes de très grande qualité, justifiant cette appréciation élogieuse de
Jean-Baptiste Dumas : "Il a dépassé Priestley et... il s'est quelquefois
approché de Lavoisier."
C'est dans un mémoire paru en 1774 qu'il révèle la découverte de "l'acide
muriatique déphlogistiqué", rebaptisé chlore par
Gay-Lussac en 1815, en
raison de sa couleur verdâtre. La matière première utilisée est la "magnésie
noire", dont le nom, trompeur, désigne le dioxyde de manganèse. Sous l'action de
l'acide muriatique (autre nom de l'acide chlorhydrique), cette "magnésie noire"
donne naissance à un nouveau gaz qui teint en jaune la vessie de porc dans
laquelle il a été recueilli, et a la même odeur que l'eau régale. La réaction de
synthèse du chlore ainsi réalisée peut se résumer par l'équation chimique
moderne : MnO2 + 4 HCl = MnCl2 + 2 H2O + Cl2 où MnCl2 est le chloryde de manganèse, H2O l'oxygène et Cl2 le chlore.
Cette découverte n'a jamais été contestée à
Scheele. En revanche, la publication
tardive de son fameux Traité chimique de l'air et du feu (1777), rapportant des
travaux réalisés en 1771-1772, n'a pas permis d'homologuer officiellement sa
découverte de l'oxygène (sous le nom d'air "de feu"), pourtant effectuée avant
les recherches de Priestley, de
Bayen et de
Lavoisier : en effet, en chauffant
cette fameuse "magnésie noire", Scheele isole un gaz capable de provoquer la
combustion du charbon. Il obtient également cet air "de feu" par chauffage du
précipité per se. Mais cette découverte essentielle reste confidentielle,
et c'est Priestley qui sera le premier à rendre public l'air "déphlogistiqué".
L'attachement de
Scheele à la théorie du phlogistique l'a, comme
Priestley,
empêché de tirer les conclusions définitives auxquelles seul
Lavoisier sut
aboutir.
On oublie trop souvent de mettre au crédit de
Scheele la découverte d'un nombre
important de produits organiques que ses procédés de chauffage, moins brutaux
que ceux de ses contemporains, lui permirent d'identifier et d'isoler (nombreux
acides organiques, glycérol sous le nom de "principe doux des huiles", etc.). La
modestie de leur auteur a cependant interdit à ses travaux de recevoir l'accueil
qu'ils méritaient.
Lavoisier et la réaction chimique
Avec les travaux du français Antoine Laurent de
Lavoisier, et particulièrement
sa théorie de l'oxydation, la chimie connaît, dans la seconde moitié du XVIIIème
siècle une véritable révolution, qui marque l'avènement de la chimie moderne.
On considère généralement que c'est le 1er novembre 1772 qu'est née la grande
révolution chimique. C'est en effet ce jour-là que
Lavoisier remet au secrétaire
de l'Académie des sciences un pli cacheté dans lequel il revendique la
découverte de la prise de poids du soufre et du phosphore lors de leur
combustion, qu'il compare à la prise de poids observée lors de la formation des
chaux métalliques. L'originalité de ce texte, c'est qu'il comporte une
contre-expérience où l'on constate, lors du passage d'une chaux à un métal, une
production d'air. On trouve là déjà la méthode de travail de
Lavoisier : une
affirmation reposant sur une expérience et confirmée par une contre-expérience.
La vraie nouveauté consiste, en fait, en la généralisation au soufre, puis à
l'ensemble des corps d'observations - par Guyton de Morveau sur les métaux et
par Mitouard sur le phosphore -, afin de constituer une théorie générale de la
combustion.
Lavoisier ne fait alors pas encore vraiment la différence entre l'air
atmosphérique - l'air produit par la décomposition des chaux - et l'air fixe (le
dioxyde de carbone) de Black. C'est pourquoi, le 20 février 1773, il place en
tête de son cahier de laboratoire un programme de recherche. Son premier
ouvrage, le premier tome des Opuscules physiques et chimiques, paraît en 1774 ;
il peut être considéré comme la démonstration expérimentale des affirmations
contenues dans le pli cacheté de 1772.
Depuis longtemps,
Rouelle et
Macquer ont observé que le précipité
per se (l'oxyde mercurique, HgO) donne naissance par chauffage à du mercure.
L'apothicaire des armées Pierre
Bayen (1725-1798) a montré en 1774 que cette
formation de mercure s'accompagne d'un dégagement gazeux. En Angleterre,
Priestley a constaté que ce gaz a la propriété de raviver la flamme d'une
chandelle. Rappelons qu'après avoir communiqué ses observations à Lavoisier, il
est le premier à publier sa découverte de l'oxygène sous le nom d'air
déphlogistiqué. Dans le même temps,
Lavoisier se met au travail et isole
également l'oxygène, sous nom d'air vital.
Tous deux identifient également l'azote, qui n'est pour
Priestley que de l'air phlogistiqué, alors que pour
Lavoisier, il s'agit d'un gaz d'une nature
différente de celle de l'air vital. Dans la foulée, Lavoisier étudie la
composition de l'air, ainsi que le rôle de l'oxygène dans la respiration et la
combustion. Se fondant sur l'exemple du soufre qui, en fixant l'air vital,
conduit à l'acide vitriolique, il pense que l'oxygène est un constituant
indispensable des acides ; c'est pourquoi il lui donne en 1779 le nom de
principe oxigine, puis de principe oxigène, notre oxygène - du grec oxus,
"acide", et de gennaein, "engendrer".
En dépit de l'antériorité de
Cavendish
ou de Macquer et Sigaud de la Fond (1776), l'expérience publique de
décomposition et de recomposition de l'eau menée en 1783 est d'une grande importance.
Lavoisier parvient en effet à décomposer l'eau en air vital (oxygène) et en air
inflammable (hydrogène), puis à le recomposer à partir de ces deux gaz. Il
démontre ainsi que l'eau n'est pas un élément, mais qu'elle est composée
d'oxygène et d'hydrogène.

Les merveilles de la science ou description populaire des inventions modernes,
de Louis Figuier, Industrie de l’eau, page 5 (1877)
Les découvertes de la chimie pneumatique finissent par jeter le discrédit sur la
théorie du phlogistique. Dès 1774,
Bayen a porté la première attaque,
Lavoisier
prend le relais en 1777, mais c'est en 1785 qu'il lit devant l'Académie ses
Réflexions sur le phlogistique, où il conclut que le phlogistique n'existe pas,
puisque tout peut s'expliquer sans lui. Petit à petit, à l'exception de
Priestley qui demeurera phlogisticien, les chimistes abandonneront la "sublime
théorie" pour rallier la théorie de l'oxydation de
Lavoisier.
Les conceptions de
Lavoisier ne peuvent s'accommoder de la nomenclature
fantaisiste léguée par les alchimistes. Déjà,
Guyton de Morveau (1737-1816) a
cherché à rationaliser le système et a publier en 1782 un Tableau de
nomenclature chimique. En 1787, il faut paraître, avec
Lavoisier, Claude Louis
Berthollet (1748-1822) et Antoine de
Fourcroy (1755-1809) la Méthode de
nomenclature chimique, qui fixe les grands principes encore en usage : la
méthode utilisée pour décrire le nom d'une substance composée doit exprimer sa
constitution. Le vitriol de vénus, au nom si évocateur, s'appellera désormais
sulfate d'oxyde de cuivre ou, plus simplement, sulfate de cuivre. La poésie
s'efface devant les exigences de la science...
En 1789,
Lavoisier publie son
Traité élémentaire de chimie, manuel pédagogique
qui est aussi une sorte de propagande pour la théorie de l'oxydation, grâce
auquel la révolution chimique va se diffuser dans le monde entier.
La théorie de
Lavoisier a le mérite de stimuler la recherche, en particulier
dans le domaine quantitatif. Joseph Louis
Proust (1754-1826) énonce la loi des
proportions définies, montrant que les composants d'un corps se trouvent dans
des proportions constantes. Une polémique l'oppose à
Berthollet, qui n'admet pas
que les produits aient une composition définie, mais
Proust garde le dernier
mot. Parallèlement, Jérémie Benjamin
Richter (1726-1807) établit la loi de
proportionnalité. Tout cela contribue à l'établissement de la notion de
stœchiométrie, qui régit les proportions des corps réagissant au cours d'une
réaction chimique.
Mise en page © 2009 - S. Bourdreux
Accueil > La Physique au temps de Sigaud de La Fond > Etat des lieux des connaissances scientifiques au XVIIIème siècle